
| A. | 将铝、铜、铁片插入浓硫酸,以证明常温下Al、Fe、Cu能否与浓硫酸反应 | |
| B. | 加过量NaOH溶液,过滤弃去沉淀,以除去混在Al2O3中的Fe2O3 | |
| C. | 将铁器、铜器放入盐酸中浸泡,以除去表面的铁锈和铜绿[Cu2(OH)2CO3] | |
| D. | 将FeCl3、CuCl2溶液在蒸发皿中加热蒸干,以制得FeCl3、CuCl2固体 |
分析 A.铝、铁常温下与浓硫酸发生钝化反应;
B.氧化铝与氢氧化钠溶液反应,但氧化铁不反应;
C.铁锈主要成分为氧化铁,铜绿主要成分为[Cu2(OH)2CO3],都与盐酸反应;
D.FeCl3、CuCl2溶液蒸发时易水解.
解答 解:A.铝、铁常温下与浓硫酸发生钝化反应,其中铝生成氧化铝,但没有明显现象,不能确定是否反应,故A错误;
B.氧化铝与氢氧化钠溶液反应,但氧化铁不反应,加入氢氧化钠,不能除去氧化铁,故B错误;
C.铁锈主要成分为氧化铁,铜绿主要成分为[Cu2(OH)2CO3],都与盐酸反应,可除去表面的铁锈和铜绿[Cu2(OH)2CO3],故C正确;
D.FeCl3、CuCl2溶液蒸发时易水解,加热溶液蒸干,可得到氢氧化铝、氢氧化铁,故D错误.
故选C.
点评 本题考查化学实验方案评价,为高频考点,侧重考查学生的分析能力和实验能力,明确实验原理及物质性质是解本题关键,根据实验操作规范性及物质性质来分析解答即可解答,难度中等.


科目:高中化学 来源: 题型:解答题
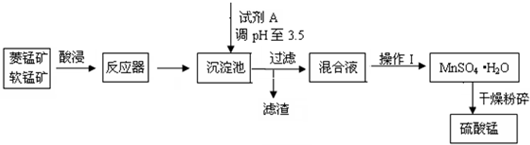
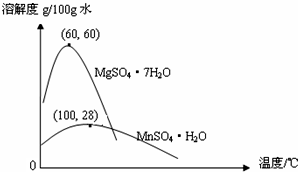
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅含有共价键的物质定是共价化合物 | |
| B. | 单质分子中均存在化学键 | |
| C. | 离子化合物中一定含有离子键,可能含有配位键和共价键 | |
| D. | 由不同种非属元素的原子形成的共价化合物一定只含极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若c=32(a+b),则b=2a | B. | 若c<32(a+b),则a>2b | ||
| C. | 若a<2b,则c=48a | D. | 若a>2b,则32(a+b)>c>96b |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
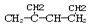 名称是1,3-二甲基-2-丁烯
名称是1,3-二甲基-2-丁烯| A. | 都不正确 | B. | ③⑤⑥正确 | C. | ②④⑥正确 | D. | ①③⑥正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 硫酸溶液/mL | 20.0 | 40.0 | 60.0 | 80.0 |
| 剩余固体/g | 9.36 | 7.12 | 4.88 | 3.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 化学式 | CH3COOH | HClO | H2CO3 |
| Ka | 1.8×10-5 | 3.0×10-8 | ka1=4.1×10-7;ka2=5.6×10-11 |
| A. | 等物质的量浓度、等体积的CH3COONa和NaClO溶液中,NaClO溶液中的离子总数多 | |
| B. | 少量的CO2通入NaClO溶液中:2ClO-+H2O+CO2═2HClO+CO32- | |
| C. | 用0.1mol/LNaOH溶液中和pH相同、体积相等的HClO和CH3COOH溶液时,HClO所需NaOH溶液体积大 | |
| D. | 相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com