
分析 (1)0.1mol该烃与足量氧气反应生成二氧化碳和水,生成产物与过氧化钠反应生成氢氧化钠、碳酸钠,根据差量法及质量增重了23.4g列出方程①,再根据反应中氧气的体积为24.64列出方程②,两个方程联立确定出该有机物分子式;
(2)该烃可以使KMnO4酸性溶液褪色,但不能使溴水褪色,说明该有机物分子中不含有碳碳双键,可以含有苯环,据此书写结构简式.
解答 解:(1)设烃的分子式为CxHy,则有
CxHy+(x+$\frac{y}{4}$)O2$\stackrel{点燃}{→}$xCO2 +$\frac{y}{2}$H2O
0.1 0.1(x+$\frac{y}{4}$) 0.1x 0.1×$\frac{y}{2}$,根据Na、C、H守恒列关系式:
CO2-Na2O2-Na2CO3 △m (即变化的固体的质量)
44 78 106 28
4.4x 2.8x
H2O-Na2O2-2NaOH△m
18 2
18×$\frac{0.1y}{2}$ 0.1y
烃燃烧消耗的氧气的体积为:22.4×0.1(x+$\frac{y}{4}$)L,
烃燃烧生成的二氧化碳、水与过氧化钠反应生成的氧气的体积为:22.4×$\frac{1}{2}$(0.1x+0.1×$\frac{y}{2}$),
最后剩余的24.64L为氧气,则:33.6L-22.4×0.1(x+$\frac{y}{4}$)L+22.4×$\frac{1}{2}$(0.1x+0.1×$\frac{y}{2}$)=24.64L ①
固体增重的质量为:2.8x+0.1y=23.4②
根据①②解得:x=8 y=10,
所以该烃的分子式为C8H10,
答:该烃的分子式为C8H10;
(2)该烃的不饱和度为:$\frac{2×8+2-10}{2}$=4,可以使KMnO4酸性溶液褪色,但不能使溴水褪色,说明该有机物分子中不含有碳碳双键,含有苯环满足题意,
那么该烃弱智含有一个支链,则为乙苯,若含有两个支链,那么可以有邻间对三种位置,故可能的结构简式为: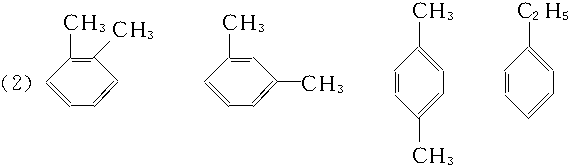 ,故答案为:.
,故答案为:. .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,注意掌握过氧化钠与二氧化碳、水反应的方程式,能够根据质量差列出固体增重15g的方程为解答本题的关键.


科目:高中化学 来源: 题型:选择题
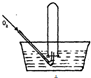 将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )
将体积为V mL的试管充满NO气体,按如图所示进行实验.当通入相同条件下O249mL时,液面仍在原来位置,则试管体积V为( )| A. | 49mL | B. | 28 mL | C. | 30mL | D. | 24.5mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚四氟乙烯的化学活动性很强 | B. | 聚四氟乙烯分子中含有双键 | ||
| C. | 聚四氟乙烯的单体是不饱和烃 | D. | 聚四氟乙烯中氟的质量分数是76% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
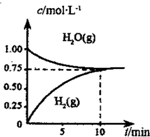 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 元素 | 结构、性质等信息 |
| A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
| B | B与A同周期,其最高价氧化物的水化物呈两性 |
| C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
| D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
 ,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有3个未成对电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com