
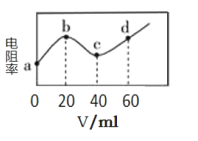
【题目】常温下,向20 mL浓度均为0.1 mol/LHX 和CH3COOH的混合液中滴加0.1 mol·L-1的NH3·H2O,测得混合液的电阻率与加入NH3·H2O 的体积(V)的关系如图所示。已知:物质的电阻率越大,导电能力越弱,CH3COOH的![]() ,NH3·H2O的
,NH3·H2O的![]() 。下列说法错误的是
。下列说法错误的是
A.常温时,0.1 mol/LHX的pH比0.1 mol/LCH3COOH 的pH小
B.a→c过程中水的电离程度先增大后减小
C.c点溶液中:c(CH3COO-)+c(X-)>c(NH4+)
D.d 点有4c(NH4+)+4c(NH3·H2O)=0.3mol/L
【答案】B
【解析】
物质的电阻率越大,导电能力越弱,则电阻率与离子浓度成反比;若HX和CH3COOH均为弱碱,则随着NH3H2O的加入,酸碱反应生成盐,溶液导电性将增强、电阻率将减小,但图象上随着NH3H2O的加入溶液电阻率增大、导电性反而减弱,说明原混合溶液中离子浓度更大,即HX为强电解质,完全电离使溶液的电阻率最小;a→b过程中溶液的导电性减弱,向混合溶液中加入等物质的量浓度的NH3·H2O溶液时,发生反应先后顺序是HX+NH3·H2O=NH4X+H2O、NH3H2O+CH3COOH=CH3COONH4+H2O,0~20溶液中电阻率增大、导电性减弱,b点最小,原因为溶液体积增大导致b点离子浓度减小,b点溶液中溶质为CH3COOH、NH4X,继续加入NH3·H2O溶液,CH3COOH是弱电解质,生成的CH3COONH4是强电解质,导致溶液中离子浓度增大,溶液的电导性增大,c点时CH3COOH和NH3·H2O恰好完全反应生成醋酸铵,c点溶液中溶质为CH3COONH4、NH4X,且二者的物质的量相等,d点溶液中溶质为等物质的量浓度的CH3COONH4、NH4X、NH3·H2O,据此分析解题。
A.由分析知HX为强酸,醋酸为弱酸,则常温时,0.1 mol/LHX溶液中c(H+)比0.1 mol/LCH3COOH溶液中 c(H+)大,即0.1 mol/LHX的pH比0.1 mol/LCH3COOH 的pH小,故A正确;
B.a点是HX和CH3COOH溶液,水的电离受抑制,b点溶质为CH3COOH、NH4X,其中醋酸的电离抑制水的电离,NH4+的水解促进水的离子,而c点溶液中溶质为CH3COONH4、NH4X,CH3COO-和NH4+的水解均促进水的离子,则a→c过程中水的电离程度递增,故B错误;
C.已知CH3COOH的![]() ,NH3·H2O的
,NH3·H2O的![]() ,则CH3COO-和NH4+浓度相等时水解程度相同,CH3COONH4溶液呈中性,c点溶液中溶质为CH3COONH4、NH4X,且二者的物质的量相等,此时溶液显酸性,即c(OH-)<c(H+),则由电荷守恒式c(OH-)+c(CH3COO-)+c(X-)=c(H+)+c(NH4+),可知c(CH3COO-)+c(X-)>c(NH4+),故C正确;
,则CH3COO-和NH4+浓度相等时水解程度相同,CH3COONH4溶液呈中性,c点溶液中溶质为CH3COONH4、NH4X,且二者的物质的量相等,此时溶液显酸性,即c(OH-)<c(H+),则由电荷守恒式c(OH-)+c(CH3COO-)+c(X-)=c(H+)+c(NH4+),可知c(CH3COO-)+c(X-)>c(NH4+),故C正确;
D.d点溶液中溶质为等物质的量浓度的CH3COONH4、NH4X、NH3·H2O,溶液体积为80mL,根据物料守恒可知 c(NH4+)+c(NH3·H2O)=![]() mol/L=0.075mol/L,即4c(NH4+)+4c(NH3·H2O)=0.3mol/L,故D正确;
mol/L=0.075mol/L,即4c(NH4+)+4c(NH3·H2O)=0.3mol/L,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】物质分类是基本的化学思路。下表是几种常见物质的分类情况:
单质 | 氧化物 | 酸 | 碱 | 盐 |
Mg、S、C、N2 | CaO、CO2 | HCl、H3BO3 | KOH、NH3 H2O | KNO3、K2S |
回答下列问题
(1)下列物质可导电的是_____________;是电解质的是_______________。
①HCl(液态) ②HCl(稀溶液) ③KOH(固体) ④KOH(熔融状态) ⑤KOH(稀溶液)
(2)从上表选择两种物质,发生反应属于化合反应但不属于氧化还原反应,该反应的化学方程式为_____________。(任写一个即可)
(3)点燃时,镁可以在氮气中燃烧,写出该反应的化学方程式,并用单线桥标出电子转移的方向和数目__________________。
(4)酸按不同标准分类得到的结果是不同的。已知H3BO3与足量NaOH溶液反应的离子方程式为:H3BO3+OH-=B(OH)4-,则H3BO3属于_____元酸,其电离方程式为______。
(5)黑火药是我国古代伟大的科学发明,反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑,若生成22.4L N2(标准状况下),则被氧化的C是_________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常用解热镇痛药对乙酰氨基苯酚(扑热息痛)为白色颗粒状晶体,易被空气氧化。实验室用对氨基苯酚乙酰化制备扑热息痛的一种方法如下:

查阅资料获得以下数据:
对氨基苯酚 | 醋酸酐 | 对乙酰氨基苯酚 | |
熔点/℃ | 189.6 ~ 190.2 | -73 | 169 ~ 171 |
密度/g·cm-3 | 1.2 | 1.1 | 1.3 |
相对分子质量 | 109 | 102 | 151 |
溶解性 | 溶于乙醇和水 | 溶于乙醇, 稍溶于水 | 易溶于乙醇和热水,溶于丙酮 |
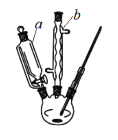
实验过程:如图所示,在三颈烧瓶中加入对氨基苯酚10.9g,再加入30 mL水。打开仪器a下端的旋塞,缓慢滴加12 mL醋酸酐。搅拌并水浴加热,控制温度在80℃左右,充分反应后按如下流程进行操作。
回答下列问题:
(1)仪器a的名称是___________,仪器b的作用是_____________。
(2)步骤②洗涤晶体获得粗品时,选择的洗涤剂是______。(填标号)
A.乙醇 B.丙酮 C.热水 D.冷水
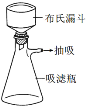
(3)减压过滤装置如图所示。步骤④减压过滤时,在吸滤瓶中要先加入适量NaHSO3,其作用是_________,该减压过滤需趁热进行,原因是_____________。
(4)步骤⑥中操作X为_______________。
(5)若最终得到9.8 g对乙酰氨基苯酚,则本实验的产率为______%。(保留1位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个容积均为2L的密闭容器Ⅰ和Ⅱ中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
N2(g)+2CO2(g),起始物质的量见下表。实验测得两容器不同温度下达到平衡时CO2的物质的量如下图所示,下列说法正确的是
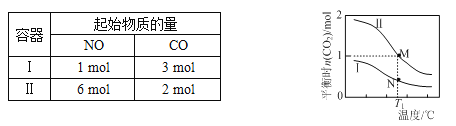
A. N点的平衡常数为0.04
B. M、N两点容器内的压强:P(M)>2P(N)
C. 若将容器Ⅰ的容积改为1 L,T1温度下达到平衡时c(CO2)=0.25 mol·L-1
D. 若将容器Ⅱ改为绝热容器,实验起始温度为T1,达平衡时NO的转化率小于16.7%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德常数为NA,则下列说法正确的是( )
A.常温常压下,11.2LCH4中含有的氢原子数为2NA
B.标准状况下,22.4 L二氧化硫中含有氧原子数为NA
C.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.1L0.1mol/L MgCl2溶液中含Mg2+数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
Ⅰ.脱硝:已知:H2的燃烧热为285.8kJ/mol
①N2(g)+2O2(g)=2NO2(g) △H1=+133kJ/mol
②H2O(g)=H2O(l) △H2=-44 kJ/mol
写出在催化剂存在下,H2还原NO2生成水蒸气和其他无毒物质的热化学方程式为___。
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2molCO2、6molH2,在适当的催化剂作用下,发生反应:CO2(g)+3H2(g)![]() CH3OH(l) +H2O(l)。
CH3OH(l) +H2O(l)。
下列叙述能说明此反应达到平衡状态的是___。
A.混合气体的平均式量保持不变 B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 molCO2生成的同时有3molH—H键断裂
(2)在T1℃时,体积为2L的恒容容器中充入物质的量之和为3mol的H2和CO,发生反应CO(g) +2H2(g)![]() CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
CH3OH(g)反应达到平衡时CH3OH的体积分数(V%)与n(H2)/n(CO)的关系如图所示。
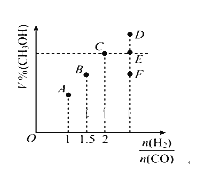
①当起始n(H2)/n(CO)=2,经过5min达到平衡,CO的转化率为0.4,则0~5min内平均反应速率v(H2)=____。若此时再向容器中加入CO(g)和CH3OH(g)各0.4mol,达新平衡时H2的转化率将____(选填“增大”、“减小”或“不变”);
②当起始n(H2)/n(CO)=3.5时,达到平衡状态后,CH3OH的体积分数可能是图象中的___点(选填“D”、“E”或“F”)。
(3)已知反应A(g)+B(g)![]() C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
C(g)+D(g)的平衡常数K值与温度的关系如表所示。830℃时,向一个2L的密闭容器中充入0.20molA和0.20molB,10s时达到平衡。
温度/℃ | 700 | 830 | 1200 |
K值 | 1.7 | 1.0 | 0.4 |
该反应是____反应(填“吸热反应”或“放热反应”);反应初始至平,A的平均反应速率v(A)=_____。达到平衡后,B的转化率为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近日某著名白酒生产企业又陷入“塑化剂”事件。据称“塑化剂”大量超标的白酒被人饮用后,可引起肝癌。常见的塑化剂DEHP分子结构如下:关于该塑化剂的说法错误的是 ( )
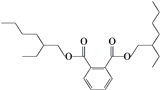
A. 塑化剂DEHP分子中含有碳、氢和氧三种元素
B. 塑化剂DEHP分子中至少含有两种官能团
C. 塑化剂DEHP分子易溶于酒精
D. 塑化剂DEHP分子可发生取代反应 加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)根据反应![]() ,回答下列问题:
,回答下列问题:
①用双线桥法标出该反应中电子转移的方向和数目:______。
②该反应中______元素被还原,______元素被氧化。
③在该反应中,若有![]() 电子发生转移,在标准状况下,可生成
电子发生转移,在标准状况下,可生成![]() 的体积为_____L。
的体积为_____L。
(2)配平化学方程式且回答下列问题:
①______ ![]() ______
______![]() ___
___![]() _____
_____![]() ___ Cl2 ___H2O
___ Cl2 ___H2O
②若生成![]() ,则被氧化的HCl是_________mol,
,则被氧化的HCl是_________mol,
(3)已知反应:2H2S+H2SO3=2H2O +3S,若氧化产物比还原产物多![]() ,则同时会生成水的质量为 ______ g。
,则同时会生成水的质量为 ______ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol某有机物的蒸气跟过量O2混合后点燃,生成13.2g CO2和5.4g H2O,该有机物跟金属反应放出H2,又能跟新制Cu(OH)2悬浊液加热时生成红色沉淀,此有机物还能跟乙酸反应生成酯类化合物.该酯类化合物的结构简式可能是( )
A. CH3CH(OCH3) CHOB. OHCCH2CH2COOCH3
C. CH3CH(OOCCH3)CHOD. OHCCH(OH) COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com