
| A. | 物质的量就是指物质的数量 | |
| B. | 硫酸的摩尔质量为98g | |
| C. | 标准状况下,0.5mol CCl4的体积为11.2L | |
| D. | 20.00 mL 0.5 mol/L的Ca(NO3)2溶液中NO3-的物质的量为0.02 mol |
分析 A.物质的量是表示微粒数目集合体的物理量;
B.摩尔质量以g/mol为单位,数值上等于其相对分子质量;
C.标况下四氯化碳为液态;
D.0.5 mol/L的Ca(NO3)2溶液中NO3-的物质的量浓度为1mol/L,根据n=cV计算NO3-的物质的量.
解答 解:A.物质的量是表示微粒数目集合体的物理量,既不是物质的数量也不是物质的质量,故A错误;
B.1mol硫酸的质量为98g,硫酸的摩尔质量为98g/mol,故B错误;
C.标况下四氯化碳为液态,0.5mol CCl4的体积远小于11.2L,故C错误;
D.0.5 mol/L的Ca(NO3)2溶液中NO3-的物质的量浓度为1mol/L,NO3-的物质的量为0.02L×1mol/L=0.02mol,故D正确,
故选:D.
点评 本题考查物质的量、摩尔质量、气体摩尔体积、物质的量浓度,比较基础,注意气体摩尔体积的使用条件与对象.


科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸,并测得某溶液pH为3.1 | |
| B. | 中和pH与体积均相同的NaOH溶液和氨水,结果消耗H2SO4的物质的量一样多 | |
| C. | 酸碱中和滴定的终点是指酸和碱恰好完全反应,此时溶液一定呈中性 | |
| D. | 在HCl气氛中蒸干AlCl3溶液能到得纯净的无水氯化铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
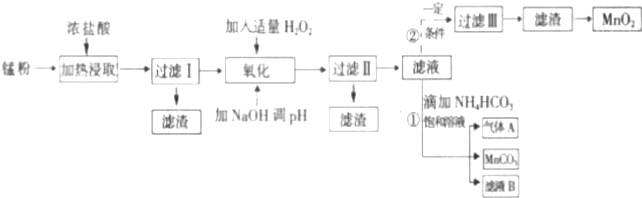
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | Zn(OH)2 |
| 沉淀开始时pH | 7.5 | 2.2 | 8.8 | 6.5 |
| 沉淀完全时pH | 9.5 | 3.7 | 10.8 | 8.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①⑥ | B. | ③⑤⑥ | C. | ②③④⑤ | D. | ①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2、N2O4 | B. | 石墨、氧气 | C. | H2SO4、HClO | D. | NaCl、Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铁与稀硝酸反应来制备氢气 | |
| B. | 氨气、液氨和氨水是同一种物质 | |
| C. | NO2溶于水发生了氧化还原反应,它既是氧化剂又是还原剂 | |
| D. | 钠在氧气中燃烧发出白光,生成白色固体氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO | H2 | CH3OH |
| 0.5mol•L-1 | 2mol•L-1 | 6mol•L-1 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
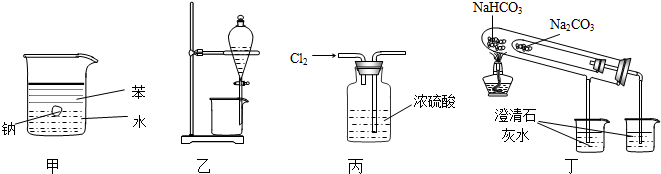
| A. | 用甲图装置证明密度ρ(苯)<ρ(钠)<ρ(水) | |
| B. | 用乙图装置分离酒精和四氯化碳 | |
| C. | 用丙图装置干燥Cl2 | |
| D. | 用丁图装置比较NaHCO3和Na2CO3的热稳定性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com