
| A. | 4m mol | B. | 10m mol | C. | $\frac{10m}{3}$mol | D. | $\frac{2m}{3}$mol |
分析 该反应中Cu元素化合价由+1价变为+2价、S元素化合价由-2价变为+6价、N元素化合价由+5价变为+2价,氧化还原反应中转移电子相等计算被还原硝酸的物质的量
解答 解:根据题意知,Cu2S与足量的稀硝酸反应生成Cu(NO3)2、H2SO4、NO和H2O,反应中Cu元素化合价由+1价升高到+2价,S元素化合价由-2价升高到+6价,则nmolCu2S共失去mmol×(2×1+8)=10mmol,
N元素化合价由+5价降低到+2价,则参加反应的硝酸中被还原的硝酸的物质的量为$\frac{10m}{5-2}$mol=$\frac{10}{3}$mmol,
故选C.
点评 本题考查氧化还原反应的计算,明确元素化合价变化是解本题关键,侧重考查基本理论、计算能力,根据转移电子守恒解答即可.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题




查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0~1min,CO的平均反应速率为o.5mol/(L•min) | |
| B. | 增大压强,化学反应速率加快,K增大 | |
| C. | H2S的平衡转化率为71.4% | |
| D. | 平衡后,又加入CO、H2各1mol,平衡逆动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
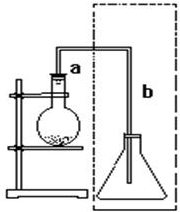 如图是实验室制取溴苯的装置,说明:
如图是实验室制取溴苯的装置,说明:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 温度 | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
 、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
、SO2、CO2及水蒸气,混合气体通过试剂的顺序是
查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com