
| A. | 标准状况下,46gCH4中含有的分子数为NA | |
| B. | 通常状况下,14gCO含有的电子数目为7NA | |
| C. | lL0.2mol•L-1的CH3COOH溶液中,H+数目为0.2NA | |
| D. | 0.1molCu与400mLlmol•L-1稀硝酸反应后,溶液中的NO3数目为为0.2NA |
分析 A.甲烷的摩尔质量为16g/mol,根据n=$\frac{m}{M}$计算出甲烷的物质的量;
B.CO分子中含有14个电子,根据n=$\frac{m}{M}$计算出一氧化碳的物质的量及含有的电子数;
C.醋酸为弱酸,在溶液中只能部分电离出氢离子;
D.根据反应3Cu+8H++2NO3-(稀)═3Cu2++2NO+4H2O及铜、硝酸的物质的量进行判断过量情况,再计算出溶液中剩余的硝酸根离子数目.
解答 解:A.46g甲烷的物质的量为:$\frac{46g}{16g/mol}$=$\frac{23}{8}$mol,含有的分子数为$\frac{23}{8}$NA,故A错误;
B.14gCO的物质的量为:$\frac{14g}{28g/mol}$=0.5mol,0.5CO中含有的电子的物质的量为7mol,含有的电子数目为7NA,故B正确;
C.lL0.2mol•L-1的CH3COOH溶液中含有0.2mol醋酸,由于醋酸为弱电解质,则电离出的氢离子小于0.2mol,H+数目小于0.2NA,故C错误;
D.铜和稀硝酸反应的离子方程式为:3Cu+8H++2NO3-(稀)═3Cu2++2NO+4H2O,硝酸的物质的量为0.4mol,0.4mol硝酸完全反应最多消耗1.5mol铜,则铜不足,0.1mol铜完全反应消耗硝酸根离子的物质的量为:0.1mol×$\frac{2}{3}$=$\frac{1}{15}$mol,剩余硝酸根离子的物质的量为:0.4mol-$\frac{1}{15}$mol=$\frac{1}{3}$mol,故D错误;
故选B.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意熟练掌握物质的量与阿伏伽德罗常数、摩尔质量等物理量之间的关系,D为易错点,需要明确反应物过量情况,根据不足量进行计算.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
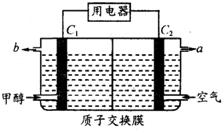 燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )
燃料电池的能量利用率比内燃机高,已应用于汽车中.如图为某燃料电池工作示意图,其中C1和C2均为多孔性纳米电极(不考虑电解质参与电极反应).下列有关说法不正确的是( )| A. | b口放出气体为CO2 | |
| B. | 质子将由C1电极区经交换膜向C2电极区运动 | |
| C. | 用该电池电解精制铜,当消耗1mol甲醇时,可溶解粗铜中3 molCu | |
| D. | 电池总反应的产物与甲醇燃烧产物一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机物就是仅有碳、氢两种元素组成的化合物 | |
| B. | 有机物都是非电解质,不能导电 | |
| C. | 组成符合CnHn的有机物分子一定互为同系物 | |
| D. | 含有醛基(-CHO)的有机物不一定是醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内有1mol A生成,有1molC消耗 | |
| B. | 混合气体的密度不变 | |
| C. | A的消耗速率与D的消耗速率相同 | |
| D. | B物质的相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 浓氨水中滴加FeCl3饱和溶液可制得Fe(OH)3胶体 | |
| B. | 一定温度下,pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| C. | CH3COONa溶液中滴加少量浓盐酸后c(CH3COO-)增大 | |
| D. | 25℃时Cu(OH)2在水中的溶解度大于其在Cu(NO3)2溶液中的溶解度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH<7的雨水就是酸雨 | |
| B. | 绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的影响 | |
| C. | 含氮、磷的大量污水任意排放是导致水华的主要原因 | |
| D. | 垃圾是放错地方的资源,应该分类回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
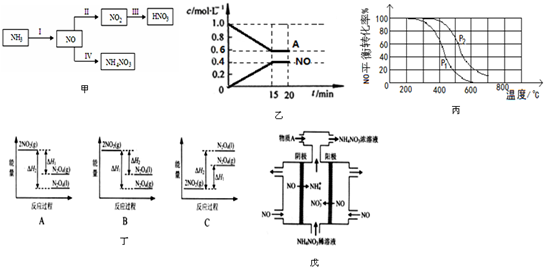
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由碳、氢、氯三种元素组成的化合物 | |
| B. | 它的分子中碳、氢、氯元素的原子个数比为1:3:3 | |
| C. | 它的相对分子质量为CH4的6倍 | |
| D. | 它是冰箱中常用的制冷剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com