
以下框图中A~M是中学化学常见的物质,其中A、E是金属,F和J为气体单质,其余均为化合物或其溶液,C为淡黄色固体,D为红棕色粉末,M为红褐色固体.

(1)B的化学式 ;
(2)19.5gC与足量的水反应转移电子的物质的量为 mol;
(3)写出物质C的电子式 ;
(4)写出②、③反应的方程式② ,③ .
考点:
无机物的推断.
专题:
推断题.
分析:
C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;D为红棕色粉末,为Fe2O3,M为红褐色固体,为Fe(OH)3,由D与稀盐酸反应得到H溶液,可知H为FeCl3,H与金属单质A反应得到K,K与氢氧化钠溶液反应得到L,L与氧气反应得到氢氧化铁,可推知L为Fe(OH)2,故A为Fe,K为FeCl2;由反应③Fe2O3+金属E Fe+B,考虑铝热反应,E为Al,B为Al2O3,电解Al2O3生成Al与O2,符合转化关系,由反应①Al与NaOH溶液反应生成NaAlO2与H2,J为气体单质,故J为H2,I为NaAlO2,据此解答.
Fe+B,考虑铝热反应,E为Al,B为Al2O3,电解Al2O3生成Al与O2,符合转化关系,由反应①Al与NaOH溶液反应生成NaAlO2与H2,J为气体单质,故J为H2,I为NaAlO2,据此解答.
解答:
解:C为淡黄色固体,能与水反应生成G溶液与F气体单质,故C为Na2O2,G为NaOH,F为O2;D为红棕色粉末,为Fe2O3,M为红褐色固体,为Fe(OH)3,由D与稀盐酸反应得到H溶液,可知H为FeCl3,H与金属单质A反应得到K,K与氢氧化钠溶液反应得到L,L与氧气反应得到氢氧化铁,可推知L为Fe(OH)2,故A为Fe,K为FeCl2;由反应③Fe2O3+金属E Fe+B,考虑铝热反应,E为Al,B为Al2O3,电解Al2O3生成Al与O2,符合转化关系,由反应①Al与NaOH溶液反应生成NaAlO2与H2,J为气体单质,故J为H2,I为NaAlO2,
Fe+B,考虑铝热反应,E为Al,B为Al2O3,电解Al2O3生成Al与O2,符合转化关系,由反应①Al与NaOH溶液反应生成NaAlO2与H2,J为气体单质,故J为H2,I为NaAlO2,
(1)由上述分析可知,B为Al2O3,故答案为:Al2O3;
(2)C为Na2O2,与水反应为2Na2O2+2H2O=4NaOH+O2↑,反应中O元素化合价由﹣1价降低为﹣2价,由﹣1升高为0价,Na2O2既是氧化剂又是还原剂,各占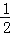 ,19.5gNa2O2的物质的量为
,19.5gNa2O2的物质的量为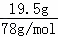 =0.25mol,Na2O2完全反应转移电子物质的量为0.25mol×
=0.25mol,Na2O2完全反应转移电子物质的量为0.25mol×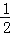 ×2=0.25mol,故答案为:0.25;
×2=0.25mol,故答案为:0.25;
(3)C为Na2O2,由钠离子与过氧根离子构成,其电子式为: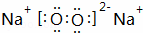 ,故答案为:
,故答案为: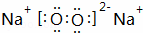 ;
;
(4)反应②是Fe(OH)2被O2氧化为Fe(OH)3,反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
反应③是Al与Fe2O3在高温条件下反应生成Fe与Al2O3,反应方程式为:Fe2O3+2Al 2Fe+Al2O3;
2Fe+Al2O3;
故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;Fe2O3+2Al 2Fe+Al2O3.
2Fe+Al2O3.
点评:
本题考查无机物推断,涉及Na、Al、Fe等元素单质及化合物的相互转化关系、常用化学用语书写等,难度中等,C为淡黄色固体,D为红棕色粉末,M为红褐色固体等是解题突破口,结合C能与水反应生成G溶液与F气体单质,推出C为过氧化钠,再结合顺推法与逆推法进行推断,对学生的逻辑推理能力有一定的要求.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
常温下,0.1mol/L某一元酸(HA)溶液中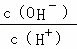 =1×10﹣8,下列叙述正确的是( )
=1×10﹣8,下列叙述正确的是( )
|
| A. | 溶液中水电离出的c(H+)=10﹣10mol/L |
|
| B. | 溶液中c(H+)+c(A﹣)=0.1 mol/L |
|
| C. | 溶液中加入一定量CH3COONa晶体或加水稀释,溶液的c(OH﹣)均增大 |
|
| D. | 与0.05mol/LNaOH溶液等体积混合后所得溶液中离子浓度大小关系为c(A﹣)>c(Na+)>c(OH﹣)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于图所示装置(盐桥含KCl)的叙述,正确的是( )
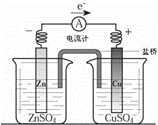
|
| A. | 铜离子在铜片表面被氧化 |
|
| B. | 铜作阳极,铜片上有气泡产生 |
|
| C. | 电流从锌片经导线流向铜片 |
|
| D. | 如图烧杯中,SO42﹣的物质的量几乎不变,K+的数目增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
相同条件下,0.1mol/L Na2S2O3溶液和0.1mol/L H2SO4溶液各5mL,与10mL水混合,反应时间为t1s;0.2mol/L Na2S2O3溶液和0.2mol/L H2SO4溶液各5mL,与30mL水混合,反应时间为t2 s,则t1和t2的关系是(忽略体积变化)( )
|
| A. | t1>t2 | B. | t1<t2 | C. | t1=t2 | D. | 不能肯定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2﹣、dZ﹣都具有相同的电子层结构,下列关系正确的是()
A. 质子数c>b B. 离子的还原性Y2﹣>Z﹣
C. 氢化物的稳定性H2Y>HZ D. 原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是()
A. 含金属元素的离子一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态时,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
查看答案和解析>>
科目:高中化学 来源: 题型:
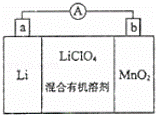
锰锂电池的体积小、性能优良,是常用的一次电池.该电池反应原 理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
理如图所示,其中电解质LiClO4溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2.回答下列问题:
(1)外电路的电流方向是由b极流向 极(填字母).
(2)电池正极反应式 .
(3)是否可用水代替电池中的混合有机溶剂?否(填“是”或“否”),原因是 .
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为 .K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com