
| A、a>b | B、a<b |
| C、a=b | D、不能确定 |
| 1 |
| 2 |


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:

| A、反应Ⅰ:△H>0,P2>P1 |
| B、反应Ⅱ:△H>0,T1>T2 |
| C、反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 |
| D、反应Ⅳ:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

A、 能与Na2CO3溶液反应生成CO2 能与Na2CO3溶液反应生成CO2 |
| B、BHT久置于空气中不会被氧化 |
| C、两种方法的反应类型都是加成反应 |
D、 与BHT互为同系物 与BHT互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、X、Y、Z中X的单质最稳定 |
| B、Y的氢化物为HY |
| C、Z的最高价氧化物的化学式为ZO2 |
| D、能发生Cl2+H2Z═Z+2HCl的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、发生化学反应时失去电子越多的金属原子,还原能力越强 |
| B、金属阳离子被还原后,不一定得到该元素的单质 |
| C、核外电子总数相同的粒子,一定是同种元素的原子 |
| D、只能与酸反应的氧化物,一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、O、Cl、S、P |
| B、K+、Mg2+、Al3+、H+ |
| C、I-、Br-、Cl-、S2- |
| D、Al3+、Mg2+、Ca2+、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
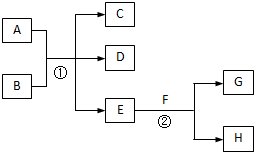 在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com