
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
科目:高中化学 来源: 题型:
答案 (1)× (2)× (3)× (4)× (5)√ (6)√
(7)× (8)√ (9)× (10)× (11)√ (12)×
解析 (1)氢键与氢有关但不属于化学键。
(2)可燃冰中水分子间存在氢键,但CH4与H2O之间不存在氢键。
(3)乙醇分子、水分子中都有—OH,符合形成氢键的条件。
(4)HI分子间只存在范德华力的作用。
(5)和(6)正确。
(7)H2与O2分子中的共价键均为非极性键,分子间只存在范德华力。
(8)H2O2分子中的H几乎成为“裸露”的质子,与水分子一样,H2O2分子间也存在氢键。
(9)卤素氢化物中,HF的熔、沸点最高。
(10)分子内氢键对物质的熔、沸点影响很小。
(11)在极性分子H2O2中存在非极性键。
(12)H2O比H2S稳定是O—H键键能大于S—H键键能,而与氢键无关。
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料,制取硝酸铜现有三种设计方案可供选用:
①Cu与稀硝酸反应制取:3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
②Cu与浓硝酸反应制取:Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O
③通氧气于铜屑与稀硝酸的体系中制取:2Cu+4HNO3+O2===2Cu(NO3)2+2H2O
下列说法正确的是( )
A.制取相同量的硝酸铜需硝酸的量③最多
B.制取相同量的硝酸铜①产生的有毒气体比②多
C.三种方案中硝酸的利用率③>①>②
D.三种方案的反应都可以在铁制容器中进行
★ ★★
查看答案和解析>>
科目:高中化学 来源: 题型:
比较下列微粒半径大小,用“>”或“<”填空
(1)Na________Mg________Cl
(2)Li________Na________K
(3)Na+________Mg2+________Al3+
(4)F-________Cl-________Br-
(5)Cl-________O2-________Na+________Mg2+
(6)Fe2+________Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z均为短周期元素,X、Y处于同一周期,X、Z的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是( )
A.原子最外层电子数:X>Y>Z
B.单质沸点:X>Y>Z
C.离子半径:X2->Y+>Z-
D.原子序数:X>Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
原子结构决定元素的性质,下列说法中正确的是( )
A.Na、Al、Cl的原子半径依次减小,Na+、Al3+、Cl-的离子半径也依次减小
B.在第ⅥA族元素的氢化物(H2R)中,热稳定性最强的一定是无毒的
C.第二周期元素原子的最外层电子数都等于其最高正化合价
D.非金属元素的非金属性越强,其氧化物对应水化物的酸性也一定越强
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子核外电子在某一时刻的位置可以测定或计算出来
B.原子核外电子的运动轨迹可以描画出来
C.人们常用小黑点的疏密程度来表示电子在原子核外出现概率的大小
D.电子云图中的小黑点表示电子的个数多少
查看答案和解析>>
科目:高中化学 来源: 题型:
处于相邻两个周期的主族元素A、B、C、D,它们的原子半径依次变小;A离子和B离子的电子层相差两层,且能形成BA2型的离子化合物;C的离子带3个正电荷;D的气态氢化物通式为H2R,D在它的最高价氧化物中的质量分数是40%,原子核中有16个中子。试回答:
(1)写出A、B、C、D的元素符号:
A:________ B:________ C:________ D:________
(2)B、C、D的第一电离能从大到小的顺序如何排列?(写元素符号,下同)______。
(3)A、B、C的电负性从大到小的顺序如何排列?________________________。
(4)向D的氢化物的水溶液中滴入少量A的单质,发生什么现象?___________,写出有关反应的化学方程式:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
结晶玫瑰是具有强烈玫瑰香气的香料,可由下列反应路线合成(部分反应条件略去):
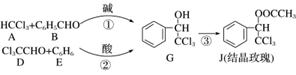
(1)A的类别是________,能与Cl2反应生成A的烷烃是________。B中的官能团是________。
(2)反应③的化学方程式为________________________________________________。
(3)已知:B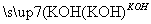 苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液,能除去的副产物是________________。
苯甲醇+苯甲酸钾,则经反应路线①得到的产物加水萃取、分液,能除去的副产物是________________。
(4)已知: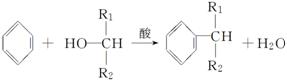 ,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为________。
,则经反应路线②得到一种副产物,其核磁共振氢谱有4组峰,各组吸收峰的面积之比为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com