
| A、加入适量的NaOH |
| B、加入适量的水 |
| C、通入适量的SO2 |
| D、加入适量CuSO4固体 |


科目:高中化学 来源: 题型:
| A、0.1a mol |
| B、0.4a mol |
| C、0.3a mol |
| D、a mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
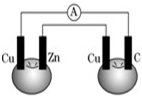 如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )
如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流计中有电流通过,则下列说法正确的是( )| A、锌片是负极 |
| B、两个铜片上都发生氧化反应 |
| C、石墨是阳极 |
| D、两个蕃茄都形成原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容量瓶中原有少量的蒸馏水 |
| B、定容时俯视刻度线和液面 |
| C、用适量蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液转移到容量瓶中 |
| D、移液时,不慎将液体流到瓶外 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | ||
B、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-═2AlO
| ||
| C、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | ||
| D、FeCl2溶液中通入足量的Cl2:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、②③④ | B、②④ |
| C、①②③④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、摩尔是表示物质质量的单位 |
| B、摩尔是表示物质数量的单位 |
| C、摩尔既表示物质微粒数量,又表示物质质量双重意义的单位 |
| D、摩尔是表示物质的量的单位,每摩尔物质含有阿伏加德罗常数个微粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 可能的实验现象 | 解释 | |
| A | 某溶液中加入硝酸酸化的氯化钡溶液 | 有白色沉淀生成 | 溶液中一定含有SO42- |
| B | 向淀粉KI溶液中不断通入C12 | 溶液变蓝后褪色 | C12先表现氧化性后表现漂白性 |
| C | CO还原Fe2O3得到的黑色固体加入盐酸溶解后再加入KSCN溶液 | 溶液不显红色 | 黑色固体没有Fe3O4 |
| D | 将SO2通入BaCl2溶液中 | 没有白色沉淀生成 | BaSO3可溶于酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳化铝,黄色晶体,熔点2200℃.熔融态不导电 |
| B、溴化铝,无色晶体,熔点98℃,熔融态不导电 |
| C、五氟化钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙铜中 |
| D、干冰,无色晶体,熔融时不导电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com