
【题目】氯水既可以用来杀菌消毒,又可作漂白剂,其中起作用的物质是( )
A.Cl2
B.HCl
C.HClO
D.H2O
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】请完成下列各小题 :
(1)![]() 的水溶液呈_______________(填“酸”“中”或“碱”)性,原因是_________________(用离子方程式表示);在实验室中配制
的水溶液呈_______________(填“酸”“中”或“碱”)性,原因是_________________(用离子方程式表示);在实验室中配制![]() 溶液时,常先将
溶液时,常先将![]() 固体溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以____________(填“促进”或“抑制”)其水解。
固体溶于较浓的硝酸中,然后用蒸馏水稀释到所需的浓度,以____________(填“促进”或“抑制”)其水解。
(2)明矾可用于净水,原因是_______________(用离子方程式表示,下同),把![]() 溶液蒸干、灼烧,最后得到的主要固体产物是____________。
溶液蒸干、灼烧,最后得到的主要固体产物是____________。
(3)泡沫灭火器的灭火原理是_____________________。
(4)纯碱可代替洗涤剂洗涤餐具,原因是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从海带中提取碘的流程如下:
![]()
(1)写出②中除烧杯外还要用到的玻璃仪器的名称:_______。
(2)有同学试图利用蒸馏方法来实现第③步操作,该同学设计了如下图蒸馏实验装置,此装置中的明显错误之处为____________ 、______________。

(3)实际操作时,利用蒸馏方法分离I2的CCl4溶液获
得I2的量大 大少于预期,试分析其主要原
因__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )

A. X和R在同一周期
B. 原子半径:W>R>X
C. 气态氢化物的稳定性:Y>X
D. X、Z形成的化合物中只有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
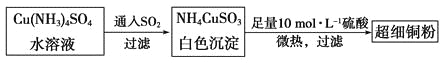
①Cu2+的价电子排布图________________; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为_______________________(填元素符号)。
②SO42-的空间构型为_____________,SO32-离子中心原子的杂化方式为__________。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式:___________。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是________
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因_____________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中某区域可以寻找制备新型农药材料的元素,它们是( )
A.左下方区域的金属元素
B.右上方区域的某些非金属元素
C.金属元素和非金属元素分界线附近的元素
D.过渡元素区域
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关碱金属性质的叙述错误的是( )
A.随核电荷数的增加,碱金属的熔、沸点降低
B.随核电荷数的增加,碱金属的密度增大
C.锂在氧气中燃烧生成过氧化锂
D.碱金属与水反应生成碱和氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是

A. 电离常数Ka(HX)的数量级为10-12
B. HX的电离程度大于X-的水解程度
C. pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D. P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是第IIIA族元素,单质硼在加热条件下能与多种非金属反应。某同学欲利用氯气和单质硼反应制备三氯化硼。已知BC13的沸点为12.5 ℃ ,熔点为-107.3 ℃,遇水剧烈反应,生成硼酸和盐酸。该同学选用下图所示的部分装置(可以重复选用)进行实验,请回答下列问题:

(1)A中反应的离子方程式为__________________。
(2)图中g管的作用是______________________________________。
(3)装置的连接顺序依次为A→ → → →E→D→F;____________在E、F装置间连接D装置的作用是____________________________________________________________。
(4)停止实验时,正确的实验操作是______________________________________________________________________________________________________________。
(5)若硼酸(H3BO3)为一元弱酸,则其钠盐NaH2BO3为_____(填“正盐”或“酸式盐”或“碱式盐”)。
(6)实验完成后,某同学向F中(溶液含有0.05mol/LNaC1O、 0.05mol/LNaCl、0.1mol/LNa0H)滴加品红溶液,发现溶液褪色。现设计实验探究溶液褪色的原因,请在表中空格处填上数据,完成实验方案。
实验序号 | 0.1mol/LNaClO溶液/mL | 0.1mol/LNaCl溶液/mL | 0.2mol/LNaOH溶液/mL | H2O /mL | 品红 溶液 | 现象 |
① | 5.0 | 0 | 0 | x | 4滴 | 较快褪色 |
② | 0 | 5.0 | 5.0 | 0 | 4滴 | 不褪色 |
③ | 5.0 | 0 | 5.0 | 0 | 4滴 | 缓慢褪色 |
则x=_______,结论:________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com