
A、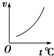 |
B、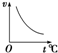 |
C、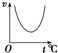 |
D、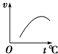 |


科目:高中化学 来源: 题型:
| A、(CH3)2CHCH2CH2CH3 |
| B、(CH3CH2)3CCH3 |
| C、(CH3)2CHCH(CH3)2 |
| D、(CH3)3CCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B、常温下,1mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C、在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D、硫酸铜溶液显酸性的原因:Cu2++2H2O═Cu(OH)2↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若a>7,则一定有V<20 |
| B、若a=7,则一定有c(Na+)=c(X-) |
| C、若V<20,则一定有c(Na+)>c(X-)>c(OH-)>c(H+) |
| D、若V=20,则一定有c(Na+)+c(H+)=c(HX)+c(X-)+c(OH+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、冰醋酸是弱电解质,液态时能导电 |
| B、强电解质溶液的导电能力不一定比弱电解质强 |
| C、盐酸中加入固体NaCl,因Cl-浓度增大,所以溶液酸性减弱 |
| D、电解质达到电离平衡后,各种离子的浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一个16O原子的质量为16 g | ||
| B、氧元素的近似相对原子质量为(16a%+17b%+18c%) | ||
C、氧元素的近似相对原子质量为:
| ||
| D、氧元素的相对原子质量为(16a%+17b%+18c%) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单位时间内生成n mol A2的同时消耗n mol B2 |
| B、容器内,AB、A2、B2三种气体共存 |
| C、AB的消耗速率等于A2的消耗速率 |
| D、容器中各组分的体积分数不随时间变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.
已知:N2O4(g)?2NO2(g)△H=+57.20kJ?mol-1.| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com