
| A. | 外观澄清、稳定 | B. | 分散质粒子直径为1---100nm | ||
| C. | 分散至粒子能透过半透膜 | D. | 丁达尔现象 |
 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:解答题
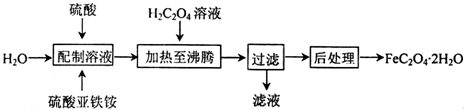

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3 | B. | NaOH | ||
| C. | CH3COONa NaOH | D. | Na2CO3 CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A元素的核外电子数和电子层数相等 |
| B元素原子的核外p电子数比s电子数少1 |
| C原子的第一至第四电离能如下: I1=738kJ•mol-1 I2=1451kJ•mol-1 I3=7733kJ•mol-1 I4=10540kJ•mol-1 |
| D原子价电子层的p轨道半满 |
| E元素的主族序数与周期数的差为4 |
| F是前四周期中电负性最小的元素 |
| G在周期表的第七列 |
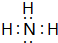 .
.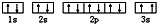 ,该同学所画的电子排布图违背了泡利原理.
,该同学所画的电子排布图违背了泡利原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用食醋清洗热水瓶胆内壁附着的水垢(CaCO3) | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 为了增加食物的营养成分,可以大量使用食品添加剂 | |
| D. | 高纯度的硅单质用于制作光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
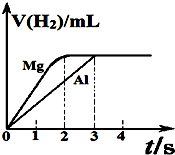 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(v)反应时间(t)的关系如图.则下列说法正确的是( )| A. | 镁、铝消耗硫酸的物质的量之比为2:3 | |
| B. | 参加反应的镁、铝的质量之比为4:3 | |
| C. | 反应消耗镁、铝的摩尔质量之比为2:3 | |
| D. | 反应中镁、铝转移电子的物质的量之比为2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol白磷分子晶体中,含有的共价键为6mol | |
| B. | 离子晶体在熔化时,离于键被破坏,而分子晶体熔化时,化学键未被破坏 | |
| C. | 在NaCl晶体中每个Na+(或C1-)周围都紧邻6个Cl- (或Na+) | |
| D. | 由于氢键作用,HF是一种非常稳定的化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com