
碱式次氯酸镁[BMH化学式为Mg2ClO(OH)3•H2O]难溶于水,相对稳定,是一种有开发价值的无机抗菌剂.某研发小组通过下列流程制备碱式次氯酸镁:
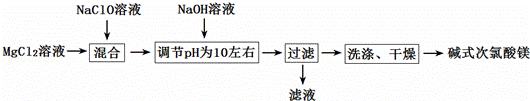
(1)在上述流程中,“过滤”操作用到的硅酸盐材质的仪器有
(2)NaClO的电子式为 ,NaClO溶液可用Cl2与NaOH溶液反应获得,写出该反应的离子方程式
(3)有效氯的含量是衡量次氯酸盐氧化能力的重要指标.次氯酸盐的有效氯含量可用次氯酸盐与盐酸反应所生成的氯气的含量来表示,则生成氯气的离子方程式为
(4)就抗菌和杀菌效果而言,氯制剂具有广谱、高效的特点,像BMH这样难溶又稳定的氯制剂几乎别无他物.在酸性溶液中BMH具有杀菌、漂白作用的原因是 (用离子方程式表示)
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,其化学方程式为 .
考点: 制备实验方案的设计.
分析: 氯化镁溶液与次氯酸钠溶液混合后,加入氢氧化钠溶液调节溶液pH,发生反应:2MgCl2+NaClO+3NaOH+H2O=Mg2ClO(OH)3•H2O↓+4NaCl,然后通过通过过滤、洗涤、干燥获得碱式次氯酸镁,
(1)根据过滤操作方法判断使用的硅酸盐仪器;
(2)次氯酸钠为离子化合物,电子式中阴阳离子都需要标出电荷;氢氧化钠与氯气反应生成氯化钠、次氯酸钠和水;
(3)次氯酸根离子与氯离子在酸性条件下反应生成氯气,据此写出反应的离子方程式;
(4)在酸性溶液中BMH与氢离子反应生成次氯酸,次氯酸具有杀菌消毒、漂白的作用;
(5)混合溶液中加入NaOH溶液并调节pH在10左右,即生成Mg2ClO(OH)3•H2O,据此可写出反应的化学方程式.
解答: 解:氯化镁溶液与次氯酸钠溶液混合后,加入氢氧化钠溶液调节溶液pH,发生反应:2MgCl2+NaClO+3NaOH+H2O=Mg2ClO(OH)3•H2O↓+4NaCl,然后通过通过过滤、洗涤、干燥获得碱式次氯酸镁,
(1)过滤操作时需要用到的硅酸盐仪器有玻璃棒、烧杯、漏斗,
故答案为:烧杯、玻璃棒、漏斗;
(2)NaClO是离子化合物,由Na+离子和ClO﹣离子构成,NaClO的电子式为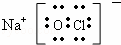 ;氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
;氯气与氢氧化钠溶液反应的离子方程式为:Cl2+2OH﹣=Cl﹣+ClO﹣+H2O,
故答案为: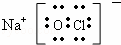 ;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
;Cl2+2OH﹣=Cl﹣+ClO﹣+H2O;
(3)次氯酸盐与盐酸反应所生成的氯气,反应的离子方程式为:Cl﹣+ClO﹣+2H+=Cl2↑+H2O,
故答案为:Cl﹣+ClO﹣+2H+=Cl2↑+H2O;
(4)Mg2ClO(OH)3•H2O在酸性条件下发生反应:Mg2ClO(OH)3•H2O+4H+=2Mg2++HClO+4H2O,反应生成的次氯酸具有强氧化性,所以在酸性溶液中BMH具有杀菌、漂白作用,
故答案为:Mg2ClO(OH)3•H2O+4H+=2Mg2++HClO+4H2O;
(5)在混合溶液中加入NaOH溶液并调节pH在10左右,即生成BMH,反应的化学方程式为:2MgCl2+NaClO+3NaOH+H2O=Mg2ClO(OH)3•H2O↓+4NaCl,
故答案为:2MgCl2+NaClO+3NaOH+H2O=Mg2ClO(OH)3•H2O↓+4NaCl.
点评: 本题考查了制备方案的设计方法,题目难度中等,涉及化学实验基本操作方法及仪器的使用、离子方程式、化学方程式、电子式的书写等知识,明确制备原理为解答关键,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:
下列过程放出热量的是(1)铝放入盐酸中(2)水蒸气变成掖态水(3)氧分子变成氧原子(4)煅烧石灰石生成生石灰和二氧化碳( )
|
| A. | (1)(2) | B. | (3)(4) | C. | (1)(3) | D. | (2)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W、Q、R均为前四周期元素,且原子序数依次增大.其相关信息如下表所示:
X的基态原子中电子分布在三个不同的能级中,且每个能级中的电子总数相同
Y元素的族序数是周期序数的三倍
Z元素的电负性在所有元素中最大
W原子的第一至第六电离能分别为:I1=578KJ•mol﹣1,I2=1817KJ•mol﹣1,I3=2745KJ•mol﹣1,I4=11575KJ•mol﹣1,I5=14830KJ•mol﹣1,I6=18376KJ•mol﹣1
Q为前四周期中电负性最小的元素
R原子最高能层上只有1个单电子,其余各能层均已充满电子.
请回答:
(1)R在周期表中位于 区,写出R基态原子的价电子排布式 .
(2)X与Y形成的二元化合物中属于非极性分子的 (用化学式表示).
(3)写出Z元素的单质与水反应的方式 ,此反应中氧化剂与氧化产物物质的量之比为 .
(4)X的氯化物的熔点比Q的氯化物的熔点 (“高”或“低”),理由是 .
(5)光谱证实单质W与强碱性溶液反应有[W(OH)4]﹣生成,则中[W(OH)4]﹣﹣存在 (填选项字母)
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键
(6)金刚砂(SiC)的结构与金刚石(4个碳原子在立方体体内,其余碳原子分别位于面心和顶角)相似,硬度与金刚石相当,则金刚砂的晶胞中含有 个硅原子, 个碳原子,其中硅原子的杂化方式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子或分子组在溶液中能大量共存的是( )
A. K+ NO3﹣ I﹣ H2SO3
B. Na+ Fe3+ NO3﹣ SCN﹣
C. K+ AlO2﹣ CO32﹣ Al3+
D. NH4+ Mg2+ SO42﹣ CH3COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C、D之间的转化关系如图所示.下列说法正确的是( )
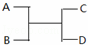
A. 若A为Fe,D为氢气,则B一定为酸
B. 若A、D为化合物,B为水,则C一定是气体单质
C. 若A、B、C、D均为化合物,该反应一定属于复分解反应
D. 若A、B、C、D均为10电子微粒,且C是可使湿润的红色石蕊试纸变蓝的气体,则D常温下一定呈液态
查看答案和解析>>
科目:高中化学 来源: 题型:
100mL浓度为2mol/L的盐酸跟略过量的锌片反应,为减慢反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量醋酸钠溶液 D.加入适量的硝酸钾溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com