
 NH2COONH4(s) + Q (Q > 0 )
NH2COONH4(s) + Q (Q > 0 ) 
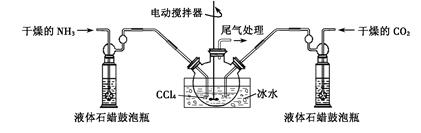
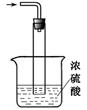
 NH3·H2O
NH3·H2O NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。
NH4++OH-,所以要利用浓氨水制备氨气,可以把浓氨水滴入到固体氧化钙或氢氧化钠,在溶解过程中放热且溶液中c(OH-)增大,使浓氨水分解生成氨气。 NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。
NH2COONH4(s)+Q是放热反应,降低温度平衡向正反应方向进行,有利于氨基甲酸铵上网生成。且氨基甲酸铵受热易分解,所以反应过程中需要用冰水冷却。 ×100%=80%。
×100%=80%。

科目:高中化学 来源:不详 题型:实验题
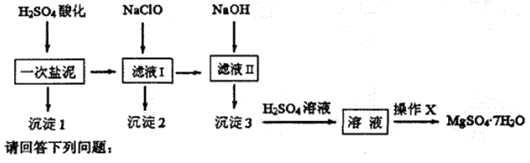
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

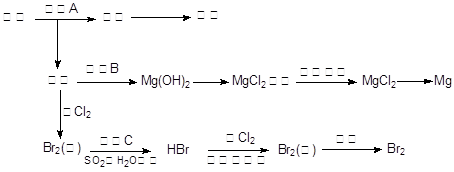
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 实验步骤及现象 |
| A | 检验亚硫酸钠试样是否变质 |  |
| B | 检验某卤代烃是否是氯代烃 |  |
| C | 证明酸性条件H2O2氧化性比I2强 |  |
| D | 除去铁屑表面的油污 | 铁屑用热的碳酸钠溶液洗涤,再用蒸馏水冲洗干净 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 实验 | P2O5 /g | 95%乙醇量/ mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
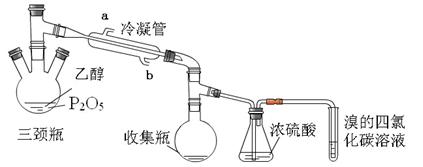
| 实验 | 实验现象 | ||
| 三颈瓶 | 收集瓶 | 试管 | |
| 实验1 | 酒精加入时,立刻放出大量的白雾,开始有气泡产生,当用酒精灯加热时,气泡加快生成并沸腾,生成粘稠状液体。 | 有无色液体 | 溶液褪色 |
| 实验2 | 酒精加入时,有少量白雾生成,当用水浴加热时,不产生气泡,反应一个小时,反应瓶内生成粘稠状液体 | 有无色液体 | 溶液不褪色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
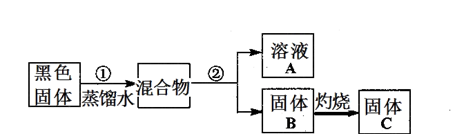
| 实验操作 | 预期现象 | 结论 |
| 步骤1:各取少量溶液A分装a、b、c三支试管,往a试管,__ __________________________ | 有白色沉淀产生 | 说明溶液A含有Cl- |
| 步骤2:往b试管,__________ __________________________ | ______________________ | _______________________ |
| 步骤3:往c试管,__________ __________________________ | 先产生_______________, 后____________________ | 说明溶液A含有Zn2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com