
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ/mol
O2(g)=H2O(l) ΔH=-285.8 kJ/mol
②H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8 kJ/mol
O2(g)=H2O(g) ΔH=-241.8 kJ/mol
③C(s)+![]() O2(g)=CO(g) ΔH=-110.5 kJ/mol
O2(g)=CO(g) ΔH=-110.5 kJ/mol
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_______。
(2)H2的燃烧热为_______,C的燃烧热为_______。
(3)燃烧10 g H2生成液态水,放出的热量为_______。
(4)CO的燃烧热为_____________,其热化学方程式为________________。
【答案】①②③④ 285.8 kJ/mol 393.5 kJ/mol 1 429.0 kJ 283.0 kJ/mol CO(g)+1/2O2(g)=CO2(g) ΔH=-283.0 kJ/mol
【解析】
(1)所有燃烧均为放热反应,故①②③④均为放热反应。
(2)燃烧热为1 mol纯物质完全燃烧生成稳定氧化物时放出的热量,H2的燃烧热为285.8 kJ/mol,C的燃烧热为393.5 kJ/mol。
(3)Q放=![]() ×285.8 kJ/mol=1 429.0 kJ。
×285.8 kJ/mol=1 429.0 kJ。
(4)根据盖斯定律由④-③可得,CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0 kJ/mol,故CO的燃烧热为283.0 kJ/mol。
O2(g)=CO2(g)ΔH=-283.0 kJ/mol,故CO的燃烧热为283.0 kJ/mol。


科目:高中化学 来源: 题型:
【题目】25℃时,向25ml氢氧化钠标准溶液中逐滴加入0.2mol·L1的一元酸HA溶液,PH变化曲线如下图所示:

(1)该氢氧化钠溶液的物质的量浓度为__________mol·L1。
(2)A点对应酸的体积为12.5ml,则所得混合溶液中由水电离出的c(OH)= _______mol·L1。
(3)HA是____酸(选填“强”、“弱”)。
(4) 在B点所得混合溶液中,c(Na+)、c(A)、c(H+)、c(OH) 的大小的顺序是_____________。
(5)在C点所得混合溶液中,下列说正确的是________。
A.HA的电离程度小于NaA的水解程度
B.离子浓度由大到小的顺序是c(Na+)>c(A)>c(H+)>c(OH)
C.c(Na+) + c(H+) = c(A-) + c(OH)
D.c(HA) + c(A) = 0.2mol·L1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)常温下,甲、乙两种溶液体积都为1L,甲中溶有0.1molCH3COOH,乙中溶有0.1molHCl和0.1molCH3COOH,测得甲溶液中c(CH3COO-)=a molL-1,乙溶液中c(CH3COO-)=b molL-1,分别用含a、b的代数式表示醋酸的电离平衡常数___、___。(忽略水的电离)两溶液中CH3COOH的电离平衡常数甲__乙(填“>”“<”“=”,下同);两溶液中CH3COOH的电离度甲___乙;a和b的值:a___b。
(2)已知 常温下CH3COOH的电离平衡常数Ka=1.8×10-5,在0.1mol/L的CH3COOH溶液中加入NaOH溶液,当溶液中c(CH3COO-) =c(CH3COOH)时,该溶液pH=___(可用对数形式表示),当溶液的pH =7时,c(CH3COO-)/c(CH3COOH)=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2AB+3C,在下列四种状态中,处于平衡状态的是( )
选项 | 正反应速率 | 逆反应速率 |
A | vA=2 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
B | vA=2 mol·L-1·min-1 | vC=2 mol·L-1·min-1 |
C | vA=1 mol·L-1·min-1 | vB=2 mol·L-1·min-1 |
D | vA=1 mol·L-1·min-1 | vC=1.5 mol·L-1·min-1 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于分子晶体的是( )
A. 熔点是10.31℃,液态不导电,水溶液能导电
B. 熔点是1070℃,固态不导电,熔融状态能导电,易溶于水
C. 熔点3550℃,不溶于水,不导电
D. 熔点是97.80℃,质软,固态可导电,密度是0.97g·cm﹣3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。
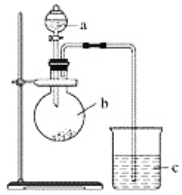
(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知W、X、Y、Z均为短周期元素,常温下,它们的最高价氧化物对应的水化物溶液(浓度均为0.01mol·L-1)的pH和原子半径、原子序数的关系如图所示。下列说法正确的是( )

A.化合物X2Y2中含有极性共价键和非极性共价键
B.简单气态氢化物的热稳定性:Y>W
C.简单离子半径:Z>Y>W>X
D.这四种元素中,元素X的第一电离能最小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上联合生产碳酸氢钠和氯代烃的工艺流程如图所示,在生产NaHCO3的过程中完成乙烯氯化,下列叙述错误的是( )
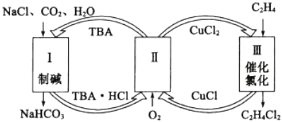
A.过程Ⅰ中的TBA替代了侯德榜制碱法中的氨气
B.在过程Ⅱ中实现了TBA、CuCl2的再生
C.过程Ⅲ中的反应方程式为C2H4+2CuCl2![]() C2H4C12+2CuC1
C2H4C12+2CuC1
D.理论上每生成1 mol NaHCO3,可得到1 mol C2H4C12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】.某盐是一种重要的化工原料,在印染、制革、木材和农业等领域有重要用途,其溶液可能含有NH4+、Al3+、SO42-、Fe2+、Cl-等若干种离子,某同学设计并完成了如下实验:
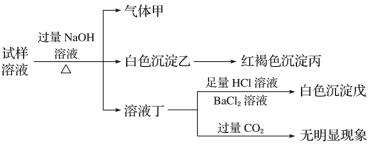
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中肯定有NH4+、SO42-和Fe2+
B.试样中一定没有Al3+
C.若气体甲在标准状况下体积为0.448 L,沉淀丙和沉淀戊分别为1.07 g和4.66 g,则可判断溶液中还有Cl-
D.该盐工业上可以用作净水剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com