
分析 ①元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化;
②单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-.
解答 解:①元素化合价降低的反应物做氧化剂被还原,元素化合价升高的反应物做还原剂被氧化,反应3H2O2+Cr2(SO4)3+10KOH═2K2CrO4+3K2SO4+8H2O,反应中Cr元素化合价+3价变化为+4价,元素化合价升高失电子做还原剂被氧化,发生氧化反应,过氧化氢中氧元素化合价-1价变化为-2价,化合价降低得到电子做氧化剂被还原,发生还原反应,
故答案为:H2O2;Cr;
②单线桥是指从失去电子的一方指向得到电子的一方,上面标注电子转移总数,此反应中铬元素化合价+3价变化为+4价,被氧化电子转移6e-,用单线桥表示出该反应中电子转移的方向和数目的化学方程式为: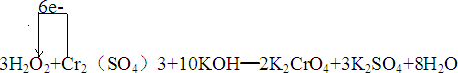 ,
,
故答案为: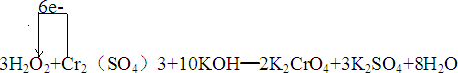 .
.
点评 本题考查了氧化还原反应,侧重于氧化还原反应基本概念和电子转移的考查,注意掌握基本概念实质和规律的应用是解题关键,题目难度不大.


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化铵晶体和碘晶体加热都产生气体 | |
| B. | KMnO4、二氧化锰分别与浓盐酸混合(可加热),都产生黄绿色气体 | |
| C. | 常温下铁和铂都不溶于浓硝酸 | |
| D. | SO2通入BaCl2溶液至饱和,再加入硝酸或苛性钠溶液,都能产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验温度/℃ | 350 | 450 |
| 平衡时n(SO3)/mol | 1.6 | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl是氧化剂 | B. | 参加反应的HCl部分被氧化 | ||
| C. | HCl被还原 | D. | 参加反应的HCl全部被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ③④⑤ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③④ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com