
【题目】某校研究性学习小组用已部分生锈(Fe2O3)的废铁屑,制作印刷电路板的腐蚀剂,即FeCl3溶液.研究过程如图:![]()
根据要求回答问题:
(1)用浓盐酸配制100ml 1mol.L﹣1稀盐酸,需要的玻璃仪器:烧杯、胶头滴管、量筒、玻璃棒、还有 , 用量筒量取一定体积的浓盐酸时,仰视会造成稀盐酸的浓度(填偏大、偏小、不变).
(2)用KSCN溶液检验溶液中Fe3+存在的离子方程式:;证明Fe3+存在的实验现象是:;
(3)甲同学认为:废铁屑加入适量的盐酸后,除了铁锈和铁都能与稀盐酸反应以外,同时还发生另一个反应,则这个反应的离子方程式为:;
(4)写出A→B反应的离子方程式:B→C变化中,写出FeCl3溶液与金属铜发生反应的化学方程式: .
(5)为了对C溶液回收利用,向C溶液中加入一定量的铁粉,充分反应后,如果溶液内有较多Cu2+和相当量的Cu,则容器内不可能有的金属或金属离子 .
【答案】
(1)100mL容量瓶;偏大
(2)Fe3++3SCN﹣=Fe(SCN)3;溶液变红色
(3)Fe+2Fe3+=3Fe2+
(4)2Fe2++Cl2=2Fe3++2Cl﹣;2FeCl3+Cu=2FeCl2+CuCl2
(5)Fe3+、Fe
【解析】解:(1)用浓盐酸配制100ml 1mol.L﹣1稀盐酸,根据配制步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶可知所需的仪器为烧杯、胶头滴管、量筒、玻璃棒、100mL容量瓶;量取浓盐酸时仰视会使量取的体积偏大,则HCl的物质的量偏大,所以配制的稀盐酸的浓度偏大;所以答案是:100mL容量瓶;偏大;(2)三价铁离子与硫氰根离子发生络合反应生成红色硫氰合铁络合物,离子方程式为Fe3++3SCN﹣=Fe(SCN)3 , Fe3+遇到KSCN溶液会变红色,溶液变红色说明Fe3+存在;所以答案是:Fe3++3SCN﹣=Fe(SCN)3;溶液变红色;(3)三氧化二铁与盐酸反应生成氯化铁和水,氯化铁具有强的氧化性,能够氧化铁生成二价铁离子,离子方程式:Fe+2Fe3+=3Fe2+;所以答案是:Fe+2Fe3+=3Fe2+;(4)氯化亚铁与氯气发生氧化反应生成氯化铁,离子方程式程式:2Fe2++Cl2=2Fe3++2Cl﹣ , FeCl3溶液与金属铜反应生成氯化亚铁和氯化铜,其反应的化学方程式为:2FeCl3+Cu=2FeCl2+CuCl2;所以答案是:2Fe2++Cl2=2Fe3++2Cl﹣;2FeCl3+Cu=2FeCl2+CuCl2;(5)氧化性:Fe3+>Cu2+>Fe2+ , 还原性Fe>Cu,向C溶液中加入一定量的铁粉,充分反应后,如果溶液内有较多Cu2+和相当量的Cu,Fe3+能氧化Cu,则溶液中不能有Fe3+ , Cu2+能氧化Fe,则不能有Fe,所以不能存在Fe3+、Fe;所以答案是:Fe3+、Fe.


科目:高中化学 来源: 题型:
【题目】能源问题日益成为制约国际社会经济发展的瓶颈。甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为2l世纪的新型燃料。工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图。
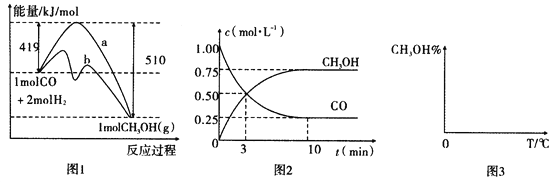
请回答下列问题:
(1)在“图1”中,曲线_____(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应。
(2)根据“图2”判断,下列说法不正确的是______________。
A.起始充入的CO为1mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=__________;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
CH3OH(g)的化学平衡常数为___________。若保持其他条件不变,向平衡体系中再充入0.5mol CO、lmolH2、1.5 molCH3OH,此反应进行的方向为____________(填“正反应方向”或“逆反应方向)”。
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线__________(在曲线上标出p1、p2,且p1>p2)。
(5)科学家常用量热剂来直接测定某一反应的反应热,现测得:CH3OH(g)+3/2O2
(g)=CO2(g)+2H2O(g) △H=-192.9kJ/mol,又知H2O(l)=H2O(g)△H=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上电解制碱的技术是用离子交换膜法,主要原料是饱和食盐水.请回答下列问题:
(1)阳离子交换膜把电解槽隔成了阴极室和阳极室,电解食盐水时,它只允许__ (填离子符号)通过.
(2)为了去除粗盐中混有的Ca2+、Mg2+、SO42﹣,下列选项中所加试剂(均为溶液)及加入顺序均合理的是__ (填选项字母)
A.先加足量的BaCl2,再加足量的Na2CO3,最后加入适量稀盐酸
B.先加入足量的NaOH,再加入足量的BaCl2,然后加入足量Na2CO3,最后加入适量稀盐酸
C.先加足量的Na2CO3,再加足量的BaCl2,然后加足量的NaOH,最后加入适量稀盐酸
D.先加足量的Ba(NO3)2,再加足量NaOH,然后再加足量的Na2CO3,最后加入适量稀盐酸
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节电能30%以上.在这种工艺设计中,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子交换膜都只允许阳离子通过.

①图中X是__ (填化学式),分析比较图示中a、b、c从大到小的顺序为__.
②写出燃料电池中负极上发生的电极反应式__.
③这样设计的主要节电能之处在于(任写出一条)__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料.
(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H22NH3 该可逆反应达到平衡的标志是__.
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间而变化
E.a mol N≡N键断裂的同时,有6a mol N﹣H键断裂
F.N2、H2、NH3的分子数之比为1:3:2
(2)某化学研究性学习小组模拟工业合成氨的反应.在容积固定为2L的密闭容器内充入1mol N2和3mol H2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如表:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率=__;该温度下平衡常数K=__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各物质,所含原子数目最多的是( )
A.标准状况下,22.4L甲烷
B.标准状况下,44.8L氮气和氧气的混合气体
C.常温常压下,66g二氧化碳气体
D.100mL 1mol/L硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.利用蓝绿藻光解水是现阶段大量获取氢气的方法
B.煤的液化是物理变化,煤经液化可得到液态燃料油
C.石油的分馏产物中含有大量不饱和烃,可使酸性高锰酸钾溶液褪色
D.垃圾焚烧处理厂把生物质能转化为热能、电能,改善城市环境
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com