
下列有关化学用语表示正确的是
A.过氧化钙(CaO2)的电子式: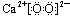
B.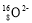 离子的结构示意图:
离子的结构示意图:
C.H2CO3的电离方程式:H2CO3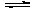 2H++CO32-
2H++CO32-
D.葡萄糖的结构简式:C6H12O6
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源:2014-2015学年山东省济宁市高三第二次模拟化学试卷(解析版) 题型:选择题
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
操作 | 现象 | 结论 | |
A | 先滴加BaCl2溶液,再加稀HNO3 | 生成白色沉淀,且沉淀不溶解。 | 原溶液中有SO42- |
B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I― |
C | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
D | 滴加NaOH溶液加热,将红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市高三第二次模拟考试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.向烧碱溶液中加入铝:Al+2OH-=AlO2—+H2↑
B.用过量氨水吸收烟道气中的SO2:SO2+2NH3·H2O=SO32—+2NH4++H2O
C.将饱和FeCl3溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.用Fe2+将饮用水中少量ClO2—还原成为Cl-:4Fe2++ClO2—+4H+=4Fe3++Cl-+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
25℃时,向10 mL 0.1 mol·L-1 CH3COONa溶液中加入0.1 mol·L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示。下列说法正确的是
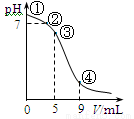
A.点①所示溶液中:c(OH-)=c(H+)+c(CH3COOH)
B.点②所示溶液中:c(CH3COOH)+c(CH3COO-)=0.05 mol·L-1
C.点③所示溶液中:c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-)
D.点④所示溶液中:c(Na+)+c(H+)<c(CH3COO-)+c(Cl-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通、扬州、连云港高三第二次调研测试化学试卷(解析版) 题型:选择题
下列指定反应的离子方程式正确的是
A.Na2O与水反应:O2-+H2O=2OH-
B.SO2使氯水褪色:SO2+Cl2+2H2O=4H++SO42-+2Cl-
C.Na2SiO3溶液与盐酸反应:Na2SiO3+2H+=H2SiO3↓+2Na+
D.Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:实验题
(14分)实验室采用简易装置模拟演示工业炼铁原理,实验装置图和实验步骤如下:
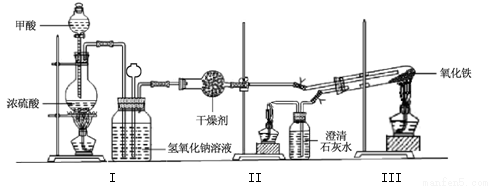
 ①按上图连接好装置,检查装置气密性。
①按上图连接好装置,检查装置气密性。
②称取适量 Fe2O3于石英试管中,点燃Ⅰ处酒精灯,缓慢滴入甲酸。
③在完成某项操作后,点燃另外两处酒精灯。
④30 min后熄灭酒精灯,关闭弹簧夹。
⑤待产物冷却至室温后,收集产物。
⑥采用如上方法分别收集带金属网罩酒精灯(金属网罩可以集中火焰、提高温度)和酒精喷灯加热的产物。
请回答下列问题:
(1)制备CO的原理是利用甲酸(HCOOH)在浓硫酸加热条件下的分解制得,盛放甲酸的仪器名称为 ,该反应的化学方程式 。
(2)实验步骤③某项操作是指 。
(3)实验步骤④熄灭酒精灯的顺序为______________。(填I,II,III)
(4)通过查资料获取如下信息:
I.酒精灯平均温度为600℃;加网罩酒精灯平均温度为700℃,酒精喷灯平均温度为930℃。
II.资料指出当反应温度高于710℃,Fe能稳定存在,680℃~710℃之间,FeO稳定存在,低于680℃,则主要是Fe3O4。试分析酒精灯加热条件下生成Fe的原因是 。
(5)已知FeO、Fe2O3、Fe3O4氧元素的质量分数分别为:22.2%、30%、27.6%。利用仪器分析测出3种样品所含元素种类和各元素的质量分数如下表:
加热方式 | 产物元素组成 | 各元素的质量分数% | |
Fe | O | ||
酒精灯 | Fe和O | 74.50 | 25.50 |
带网罩酒精灯 | Fe和O | 76.48 | 23.52 |
酒精喷灯 | Fe | 100.00 | 0.00 |
分析各元素的质量分数可知前二种加热方式得到的产物为混合物,其中酒精灯加热所得产物的组成最多有_______种可能。
(6)通过进一步的仪器分析测出前二种加热方式得到的固体粉末成分均为Fe3O4和Fe,用酒精喷灯加热得到的固体粉末成分为Fe。请计算利用酒精灯加热方式混合物中Fe3O4和Fe的质量比为_____:1。(要求保留整数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省长春市高三质量监测三理综化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的值,下列说法正确的是
A.常温常压,11.2 L NO和O2混合气体的原子数为NA
B.1.5 g甲基所含有的电子数目为0.9NA
C.1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA
D.7.8g苯中碳碳双键的数目为0.3NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省怀化市高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
[化学──选修3 :物质结构与性质](15分)X、Y 、Z、W为元素周期表前四周期的元素。其中X原子核外的L层电子数是K层电子数的两倍, Y的内层电子数是最外层电子数的9倍,Z在元素周期表的各元素中电负性最大,W元素的第三电子层处于全充满状态且第四电子层只有2个电子。请回答下列问题。
(1)W元素属于 区元素,其基态原子的电子排布式为 。
(2)W2+能与氨气分子形成配离子[W(NH3)4]2+。其中配体分子的空间构型为 ,写出该配离子的结构简式(标明配位键) 。
(3)X能与氢、氮、氧三种元素构成化合物XO(NH2)2,其中X原子的杂化方式为 ,1 mol 该分子中σ键的数目为 ,该物质易溶于水的主要原因是 。
(4)X的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图①所示,则其化学式可表示为 。
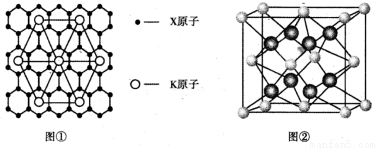
(5)元素Y与元素Z形成的晶体结构如图②所示,设晶胞中最近的Y的离子与Z的距离为a pm,该化合物的摩尔质量为bg/ mol ,则该晶胞密度的计算式为 g/cm3。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河西区高三下学期总复习质量调查(二)化学试卷(解析版) 题型:选择题
下列关于下图所示电化学装置的分析正确的是
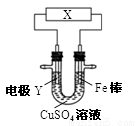
A.若X为直流电源,Y为铜棒接正极,则Fe棒上镀铜
B.若X为直流电源,Y为碳棒接负极,则Fe棒被保护
C.若X为电流计,Y为锌棒,则SO42- 移向Fe棒
D.若X为导线,Y为铜棒,则Fe棒发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com