


科目:高中化学 来源: 题型:
| A、消耗硝酸的物质的量为2.5mol |
| B、气体中N2O4的物质的量为0.1mol |
| C、生成NaNO3的物质的量为0.2 mol |
| D、生成的氮的氧化物的混合气倒置于水槽中,通入标准状况下8.96L O2时,气体完全被吸收 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1氨水,溶液的pH<13 |
| B、0.1 mol?L-1氨水加水稀释,溶液中c(H+)和c(OH-)都减小 |
| C、0.1 mol?L-1醋酸溶液中:c(H+)=c(CH3COO-) |
| D、0.1 mol?L-1醋酸与0.1 mol?L-1NaOH溶液等体积混合所得溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液中滴加Ba(OH)2溶液 |
| B、向NaAlO2溶液中滴加过量的HC |
| C、.向NaAlO2溶液中通入CO2 |
| D、l向AlCl3溶液中滴加氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
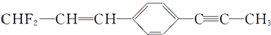 分子结构的下列叙述中,正确的是( )
分子结构的下列叙述中,正确的是( )| A、除苯环外的其余碳原子有可能都在一条直线上 |
| B、所有的原子都在同一平面上 |
| C、12个碳原子不可能都在同一平面上 |
| D、12个碳原子有可能都在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、在滴有酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的pH<7 |
| C、1.0×10-3 mol/L盐酸的pH=3.0,1.0×10-8mol/L盐酸的pH=8.0 |
| D、25℃时,若1 mL pH=1的盐酸与100 mL NaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10 mL 1 mol/L FeCl3溶液 |
| B、50 mL 0.3 mol/L NaCl溶液 |
| C、10 mL 0.2 mol/L CaCl2溶液 |
| D、200 mL 0.1 mol/L NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、18 g水中所含的电子数为10NA |
| B、1 mol氧中有2NA个氧原子 |
| C、0.3 mol?L-1Na2SO4溶液中含0.6NA个Na+ |
| D、11.2L氮气中含NA个氮原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com