
分析 由①硫酸铜溶液是蓝色的,而白色固体加水得到了无色溶液,故固体中一定不含有CuSO4;由②溶液中滴入BaCl2溶液,有白色沉淀生成沉淀为碳酸钡或硫酸钡;由③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失,则沉淀为碳酸钡,则原固体一定含Na2CO3,一定不含Na2SO4,因碳酸钠与氯化钙反应生成沉淀,结合①可知,一定不含CaCl2,以此来解答.
解答 解:由①硫酸铜溶液是蓝色的,而白色固体加水得到了无色溶液,故固体中一定不含有CuSO4;由②溶液中滴入BaCl2溶液,有白色沉淀生成沉淀为碳酸钡或硫酸钡;由③过滤,然后在此白色沉淀中加入足量稀硝酸,沉淀最后全部消失,则沉淀为碳酸钡,则原固体一定含Na2CO3,一定不含Na2SO4,因碳酸钠与氯化钙反应生成沉淀,结合①可知,一定不含CaCl2,综上所述,一定含Na2CO3,一定不含Na2SO4、CuSO4、CaCl2,可能含NaCl,
(1)固体混合物中肯定有Na2CO3,故答案为:Na2CO3;
(2)实验③中沉淀是碳酸钡,置于足量稀硝酸中,沉淀全部溶解,离子方程式为:BaCO3+2H+=Ba2++CO2↑+H2O,故答案为:BaCO3+2H+=Ba2++CO2↑+H2O;
(3)要确定氯化钠的存在取原固体溶于水需要先加硝酸酸化,再加入AgNO3溶液,生成沉淀则含NaCl,否则不含,
故答案为:取原固体溶于水需要先加硝酸酸化,再加入AgNO3溶液,生成沉淀则含NaCl,否则不含.
点评 本题考查物质检验和鉴别实验方案的设计,为高频考点,把握物质的性质及实验中现象与结论的关系为解答的关键,注意③沉淀完全溶解为解答的突破口,题目难度不大.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1mol | B. | 0.15mol | C. | 0.5mol | D. | 0.75mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (3)最少 | B. | (3)最多 | C. | 都一样多 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾可用于水的消毒、杀菌 | B. | NaHCO3可用于治疗胃酸过多 | ||
| C. | 浓硝酸保存于无色玻璃瓶中 | D. | 氢氟酸可保存于玻璃瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K1=-K2 | B. | K1=K2 | C. | K1=$\frac{1}{{K}_{2}}$ | D. | K1=$\frac{1}{2}$K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu$→_{△}^{H_{2}SO_{4}(浓)}$Cu(NO3)2 | B. | Cu$→_{△}^{空气}$CuO$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{HNO_{3}(稀)}{→}$Cu(NO3)2 | D. | Cu$\stackrel{HNO_{3}(浓)}{→}$Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
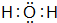 、
、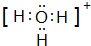 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com