


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
| A、元素的非金属性:X<Y<Z |
| B、在元素周期表中它们依次处于第ⅦA族、第ⅥA族、第ⅤA族 |
| C、酸性:H3ZO4>H2YO4>HXO4 |
| D、气态氢化物的稳定性:HX>H2Y>ZH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
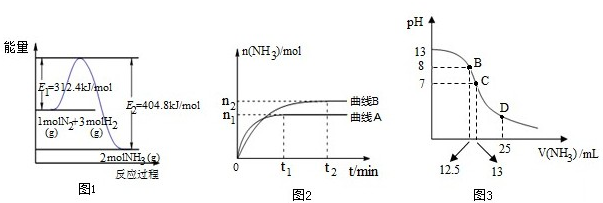
| n1 |
| 4t1 |
| 7 |
| 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸或碱 | 电离平衡常数(Ka或Kb) |
| CH3COOH | 1.8×10-5 |
| HNO2 | 4.6×10-4 |
| HCN | 5×10-10 |
| HClO | 3×10-8 |
| NH3?H2O | 1.8×10-5 |
| 难(微)溶物 | 溶度积常数(Ksp) |
| BaSO4 | 1×10-10 |
| BaCO3 | 2.6×10-9 |
| CaSO4 | 7×10-5 |
| CaCO3 | 5×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
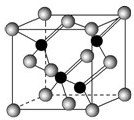 Ⅰ.2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如右图所示.试回答:
Ⅰ.2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED).目前市售LED品片,材质基本以GaAs(砷化镓)、AlGaInP(磷化铝镓铟)、InGaN(氮化铟镓)为主.已知镓是铝同族下一周期的元素.砷化镓的晶胞结构如右图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如图实验装置,请回答下列问题:
某学生为了验证苯酚、醋酸、碳酸的酸性强弱,设计了如图实验装置,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将压强减小至原来的一半 |
| B、将反应温度升高至900℃ |
| C、添加催化剂 |
| D、增大水蒸气的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com