
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第 周期第 族;W的原子半径比X的 (填“大”“小”).
(2)TY2中心原子的杂化方式为 ;XY2中一个分子周围有 个紧邻分子;堆积方式与XY2晶胞类型相同的金属有 (从“Cu、Mg、K、Po”中选出正确的),其空间利用率为 .
(3)Z的第一电离能比Mg的 (填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 .
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是,原因是 .
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T.已知:
XO(g)+1/2O2(g)═XO2(g)△H=﹣283.0kJ•mol﹣1
T(s)+O2(g)═TO2(g)△H=﹣296.0kJ•mol﹣1
此反应的热化学方程式是 .
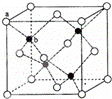
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛.立方PT晶体结构如下图所示,其晶胞边长为540.0pm,密度为 g•cm﹣3(列式并计算).
考点:
位置结构性质的相互关系应用;元素电离能、电负性的含义及应用;晶胞的计算;原子轨道杂化方式及杂化类型判断.
分析:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,Y是地壳中含量最高的元素,则Y为O元素;Z的基态原子最外层电子排布式为3s23p1,则Z为Al;W的一种核素的质量数为28,中子数为14,其质子数为28﹣14=14,故W为Si;X的最高价氧化物对应的水化物化学式为H2XO3,即最高正价为+4,原子序数小于氧,则X为C元素;常温常压下,T单质是淡黄色固体,常在火山口附近沉积,则T为S元素;P的价层电子排布为[Ar]3d104s2,则P为Zn.
解答:
解:X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,Y是地壳中含量最高的元素,则Y为O元素;Z的基态原子最外层电子排布式为3s23p1,则Z为Al;W的一种核素的质量数为28,中子数为14,其质子数为28﹣14=14,故W为Si;X的最高价氧化物对应的水化物化学式为H2XO3,即最高正价为+4,原子序数小于氧,则X为C元素;常温常压下,T单质是淡黄色固体,常在火山口附近沉积,则T为S元素;P的价层电子排布为[Ar]3d104s2,则P为Zn.
(1)W为Si,位于元素周期表第三周期第ⅣA族;同主族自上而下原子半径增大,故原子半径Si>C,
故答案为:三;ⅣA;大;
(2)SO2中心S原子价层电子对数为2+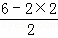 =3,故S原子的杂化方式为sp2;二氧化碳晶体为分子密堆积,分子位于晶胞的顶点与面心,CO2中一个分子周围有12个紧邻分子;堆积方式与CO2晶胞类型相同的金属为面心立方最密堆积,有Cu(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为74%,
=3,故S原子的杂化方式为sp2;二氧化碳晶体为分子密堆积,分子位于晶胞的顶点与面心,CO2中一个分子周围有12个紧邻分子;堆积方式与CO2晶胞类型相同的金属为面心立方最密堆积,有Cu(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为74%,
故答案为:sp2;12;Cu;74%;
(3)Mg的3s能级容纳2个电子,为全满稳定状态,能量较低,第一电离能高于Al,Al单质与NaOH溶液反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+H2↑,
故答案为:小;2Al+2NaOH+2H2O=2NaAlO2+H2↑;
(4)W的最高价氧化物SiO2,与NaOH溶液反应的离子方程式:SiO2+2OH﹣=SiO32﹣+H2O;二氧化硅属于原子晶体,二氧化碳属于分子晶体,故二氧化硅的熔点较高,
故答案为:SiO2+2OH﹣=SiO32﹣+H2O;SiO2;二氧化硅属于原子晶体,二氧化碳属于分子晶体;
(5)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S,反应方程式为:2CO+SO2=2CO2+S,
已知:①CO(g)+ O2(g)═CO2(g)△H=﹣283.0kJ•mol﹣1
O2(g)═CO2(g)△H=﹣283.0kJ•mol﹣1
②S(s)+O2(g)═SO2(g)△H=﹣296.0kJ•mol﹣1
①×2﹣①得:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=﹣270kJ/mol,
故答案为:2CO(g)+SO2(g)=2CO2(g)+S(s)△H=﹣270kJ/mol;
(6)P为Zn,在周期表的ds区;黑球全部在晶胞内部,该晶胞中含有黑球个数是4,白球个数=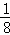 ×8+
×8+ ×6=4,化合物ZnS,晶胞ρ=
×6=4,化合物ZnS,晶胞ρ= =4.1g/cm3,
=4.1g/cm3,
故答案为:ds;4.1.
点评:
本题考查结构性质位置关系应用,涉及杂化轨道、晶体类型与性质、晶胞结构与计算、热化学方程式书写等,熟记中学常见晶胞结构,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好.一种制备Na2FeO4的方法可用化学方程式表示如下:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应下列说法中正确的是( )
|
| A. | Na2O2只作氧化剂 |
|
| B. | Na2FeO4既是氧化产物又是还原产物 |
|
| C. | O2是还原产物 |
|
| D. | 2mol FeSO4发生反应时,反应中共有8mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为VL的密闭容器中,充入a molN2和b molH2,经3分钟生成c molNH3.试回答下面问题:
(1)以N2为研究对象,计算其速率v(N2)的值
(2)求H2的转化率
(3)求3分钟时NH3的体积分数
(4)计算反应前后的压强之比.
查看答案和解析>>
科目:高中化学 来源: 题型:
下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ•mol﹣1).
| I1 | I2 | I3 | I4 | … | |
| R | 740 | 1 500 | 7 700 | 10 500 | … |
下列关于元素R的判断中一定正确的是( )
|
| A. | R的最高正价为+3价 |
|
| B. | R元素位于元素周期表中第ⅡA族 |
|
| C. | R元素的原子最外层共有4个电子 |
|
| D. | R元素基态原子的电子排布式为1s22s2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,X 原子的最外层电子数是其内层电子总数的3 倍,Y 原子的最外层只有2 个电子,Z 单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
|
| A. | 元素W 的简单气态氢化物的热稳定性比X 的强 |
|
| B. | 元素W 的最高价氧化物对应水化物的酸性比Z 的弱 |
|
| C. | 化合物YX、ZX2、WX3 中化学键的类型相同 |
|
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
查看答案和解析>>
科目:高中化学 来源: 题型:
在温度和压强不变时,1LNO2高温分解(2NO2⇌2NO+O2),达到平衡时体积变为1.2L,这时NO2的转化率为( )
|
| A. | 40% | B. | 20% | C. | 60% | D. | 5% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com