
高温下,某反应达平衡,平衡常数
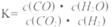
 恒容时,温度升高,H2浓度减小。下列说法正确的是
恒容时,温度升高,H2浓度减小。下列说法正确的是
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
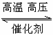 D.该反应的化学方程式为CO+ H2O CO2+H2
D.该反应的化学方程式为CO+ H2O CO2+H2
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
有硫酸镁溶液500ml,它的密度为1.20g/cm3,其中镁离子的质量分数为4.8%,则有关该溶液的说法不正确的是 ( )
A.溶质的质量分数为24.0%
B.溶液的物质的量浓度为2.4mol/L
C.溶质和溶剂的物质的量之比为1:40
D.硫酸根离子的质量分数为19.2 %
%
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:CaCO3(s)===CaO(s)+CO2(g) ΔH>0,ΔS>0.则该反应能自发进行的条件是( )
A.低温 B.高温
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
 nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
|
气体体积/L | 1 | 2 | 4 |
| 100 | 1.00 | 0.75 | 0.53 |
| 200 | 1.20 | 0.90 | 0.63 |
| 300 | 1.30 | 1.00 | 0.70 |
下列说法正确的是 ( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
石灰石的分解反应为:CaCO3(s)==CaO(s) +CO2(g)
其△H(298K)==178.2kJ·mol—1,△S(298K)== 169.6J·mol—1·K—1
169.6J·mol—1·K—1
试根据以上数据判断该反应在常温下是否自发进行?其分解温度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在425℃时,1L密闭容器中进行反应:H2(g)+I2(g)  2HI(g),以不同的方式加入反应
2HI(g),以不同的方式加入反应
物或生成物均达到平衡(如下图)
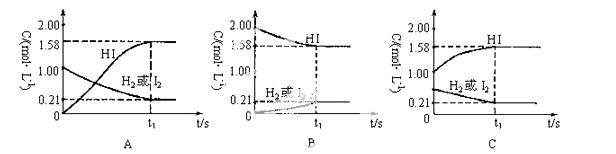
(1)将图示3种情况的反应物、生成物的初始浓度和平衡浓度填入表格。
(2)以上3种情况达到化学平衡是否为同一平衡状态?由图中的事实可以说明化学平衡具有哪些特征?
(3)等温、等容情况下,等效平衡的条件是什么?
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2M(g) N(g);△H <0。现将M和N的混和气体
N(g);△H <0。现将M和N的混和气体
通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如右图所示。下列说法正确的是( )
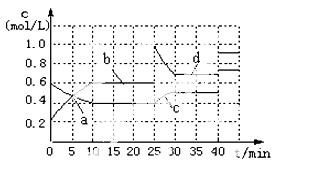
A.a、b、c、d四个点中处于平衡状态的点是a、b
B.反应进行至25min时,曲线发生变化的原因是加入了 0.4molN
C.若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度
D.若40min后出现如图所示变化,则可能是加入了某种催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验不能达到目的的是
|
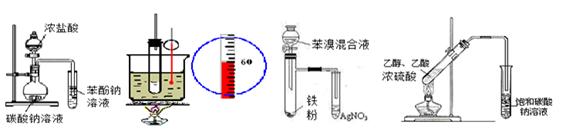
① ② ③ ④
A.①证明酸性:硫酸>碳酸>苯酚 B.②实验室制硝基苯
C.③验证苯和液溴在催化剂作用下发生取代反应 D.④实验室制乙酸乙酯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com