
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |
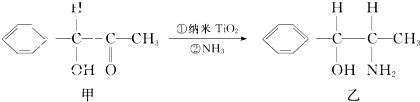
分析 (1)Ti是22号元素,其3d、4s电子为外围电子,根据构造原理书写其外围电子;化合物中各元素化合价的代数和为0,据此判断Ti元素化合价;原子个数相等、价电子数相等的微粒互为等电子体;
(2)碳原子采用sp2杂化,说明C原子价层电子对个数为3;原子采用sp3杂化,说明其价层电子对个数是4,同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
(3)这几种晶体都是离子晶体,离子晶体熔沸点与晶格能成正比;
(4)配合物中只有外界才能电离出自由移动的离子,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀,说明两种物质外界中都含有氯离子;
测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的$\frac{2}{3}$,说明绿色物质外界中氯离子是紫色物质的$\frac{2}{3}$,所以绿色物质化学式外界中含有两个氯离子、紫色物质化学式外界中含有3个氯离子,据此书写其化学式;
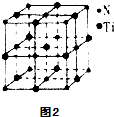
(5)晶胞中N、Ti之间的最近距离为apm,即a×10-10cm,则晶胞边长为2a×10-10cm,体积为(2a×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Ti原子个数=1+12×$\frac{1}{4}$=4,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$;
该晶体中与N原子距离相等且最近的N原子个数=3×8×$\frac{1}{2}$.
解答 解:(1)Ti是22号元素,其3d、4s电子为外围电子,根据构造原理书写其外围电子为3d24s2;化合物中各元素化合价的代数和为0,该化合物中H元素为-1价、B元素为+3价,所以Ti元素化合价为+2价;原子个数相等、价电子数相等的微粒互为等电子体,与Ti(BH4)2中的阴离子原子个数是5、价电子数为8,与CH4互为等电子体,
故答案为:3d24s2;+2;
(2)化合物甲中苯环C和羰基C以sp2杂化,共7个C;以sp3杂化方式的原子有O、N、C,由于N原子2p轨道半充满,第一电离能高于O,故答案为:7;C<O<N;
(3)这几种晶体都是离子晶体,离子晶体熔沸点与晶格能成正比,根据表中数据知,这三种物质的熔沸点高低顺序是CaO>NaCl>KCl,故答案为:CaO>NaCl>KCl;
(4)配合物中只有外界才能电离出自由移动的离子,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀,说明两种物质外界中都含有氯离子;
测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的$\frac{2}{3}$,说明绿色物质外界中氯离子是紫色物质的$\frac{2}{3}$,所以绿色物质化学式外界中含有两个氯离子、紫色物质化学式外界中含有3个氯离子,所以其化学式为[TiCl(H2O)5]Cl2•H2O,故答案为:[TiCl(H2O)5]Cl2•H2O;
(5)晶胞中N、Ti之间的最近距离为apm,即a×10-10cm,则晶胞边长为2a×10-10cm,体积为(2a×10-10cm)3,该晶胞中N原子个数=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,Ti原子个数=1+12×$\frac{1}{4}$=4,密度=$\frac{\frac{M}{{N}_{A}}×4}{V}$=$\frac{\frac{62}{{N}_{A}}×4}{(2a×1{0}^{-10})^{3}}$g/cm3=$\frac{62×4}{(2a×1{0}^{-10})^{3}{N}_{A}}$g/cm3;
该晶体中与N原子距离相等且最近的N原子个数=3×8×$\frac{1}{2}$=12,
故答案为:$\frac{62×4}{(2a×1{0}^{-10})^{3}{N}_{A}}$;12.
点评 本题考查物质结构和性质,侧重考查晶胞计算、配合物结构、晶格能、电离能等知识点,难点是晶胞计算,易错点是配位数个数的判断,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 欲粗略测定某未知浓度的醋酸溶液中醋酸的电离常数Ka,应做的实验和所需的试剂(或试纸)为:中和滴定实验、pH试纸 | |
| B. | 将0.1mol/L的NaOH溶液与0.5mol/L的CuSO4溶液等体积混合制得氢氧化铜悬浊液,用于检验麦芽糖是还原性糖 | |
| C. | 在密闭容器中加入1.5mol H2和0.5mol N2充分反应可得到NH3分子数为NA | |
| D. | 标准状况下,33.6L二氯甲烷中含有氯原子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23g由NO2和N2O4组成的混合气体中含有的氮原子数为0.5NA | |
| B. | 1.12L乙烯能与含0.05NA个溴分子的CCl4溶液恰好完全反应 | |
| C. | 1L0.1mol•L-1Fe2(SO4)3溶液中,Fe3+的数目为0.2NA | |
| D. | 7.8gNa2O2与水完全反应时转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁皮在食盐水中发生析氢腐蚀 | |
| B. | 电解池的阴极材料一定比阳极材料活泼 | |
| C. | 将铁器与电源正极相连,可在其表面镀锌 | |
| D. | 原电池的负极和电解池的阳极均发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
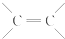 结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(
结构的有机物可被高锰酸钾溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,现以甲基丙烯(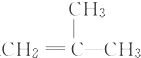 )为原料合成环状化合物F和高分子化合物E和G.
)为原料合成环状化合物F和高分子化合物E和G.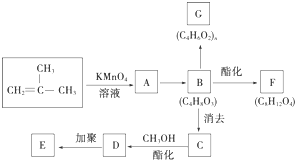
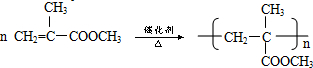
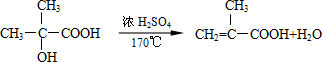 B→G的反应类型:缩聚,G的结构简式:
B→G的反应类型:缩聚,G的结构简式: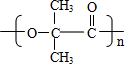 .
.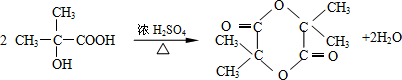 ,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为
,两分子B之间发生酯化反应除生成酯F外,还可能生成另外一种酯,该酯的结构简式为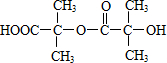 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com