
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
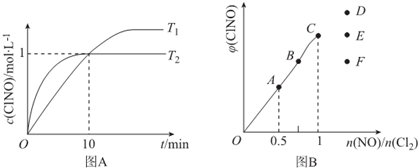
分析 (1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
由盖斯定律可知2②-①=③,焓变为倍数关系,而K为指数关系,以此计算K;
(2)根据反应的△H=反应物的总键能-生成物的总键能计算;
(3)将$\frac{②}{①}$得n,将n代入①中得k;
(4)①由图A可知T2先达到平衡状态,且生成物的浓度小,则升高温度平衡逆向移动;
②10min时c(ClNO)=1mol/L,则c(NO)=1mol/L,根据v=$\frac{△c}{△t}$计算速率;
③根据化学平衡常数为平衡时生成物浓度幂之积与反应物浓度幂之积之比计算;
(5)NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大.
解答 解:(1)已知:①2NO2(g)+NaCl(s)?NaNO3(s)+ClNO(g)K1
②4NO2(g)+2NaCl(s)?2NaNO3(s)+2NO(g)+Cl2(g)K2
③2NO(g)+Cl2(g)?2ClNO(g)K3
由盖斯定律可知2②-①=③,焓变为倍数关系,而K为指数关系,则平衡常数K3=$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
故答案为:$\frac{{{K}_{1}}^{2}}{{K}_{2}}$;
(2)反应的△H=反应物的总键能-生成物的总键能,则△H=(2×630+243)-(2a+2×607)=(289-2a)kJ/mol;
故答案为:289-2a;
(3)v正=k•cn(ClNO),则$\frac{1.44×1{0}^{-8}}{3.6×1{0}^{-9}}$=$\frac{k•0.{6}^{2}}{k•0.{3}^{2}}$,解得n=2;将n代入①中得k=$\frac{3.6×1{0}^{-9}}{0.{3}^{2}}$L/(mo1•s)=
4.0×10-8L/(mo1•s);
故答案为:2;4.0×10-8L/(mo1•s);
(4)①根据图象可知T1<T2,温度越高,反应速率越大,降低温度c(C1NO)增大,说明平衡向正反应方向移动,说明正反应是放热反应,△H<0;
故答案为:<;
②在1L的恒容密闭容器中充入2molNO(g)和1molCl2(g),10min时c(ClNO)=1mol/L,则此时c(NO)=1mol/L,v(NO)=$\frac{1mol/L}{10min}$=0.1mol/(L•min);
故答案为:0.1;
③平衡时c(ClNO)=1mol/L,c(NO)=1mol/L,c(Cl2)=0.5mol/L,则反应2NO(g)+Cl2(g)?2ClNO(g)的K=$\frac{{1}^{2}}{{1}^{2}×0.5}$=2;
故答案为:2;
(5)NO的物质的量越大其转化率越小,所以NO转化率最小的是C点;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,当n(NO)/n(Cl2)=2.8时产物的含量减小,所以应该是F点,
NO的物质的量越小其转化率越大;当反应物的物质的量之比等于其计量数之比时生成物的含量最大,为A点;当n(NO)/n(Cl2)=1.5时说较C点NO的物质的量较大,平衡右移,产物的含量增大,为D;
故答案为:A;D.
点评 本题考查化学平衡计算、外界条件对化学平衡影响因素、化学平衡状态判断等知识点,侧重考查学生分析判断及计算能力,利用三段式法进行有关计算,侧重分析与计算能力的考查,注意图象及数据的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2通常用于通讯行业 | |
| B. | 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 | |
| C. | 明矾可用作净水剂 | |
| D. | 金属钠可用于冶炼钛等金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 【化学-选修2化学与技术】
【化学-选修2化学与技术】| 化学键 | C≡O | O═O | C═O(CO2中) |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电性一定比弱电解质溶液的导电性强 | |
| B. | 水溶液中导电能力差的电解质一定是弱电解质 | |
| C. | 强电解质在稀的水溶液中全部以离子的形态存在 | |
| D. | 强电解质都是离子化合物,而弱电解质都是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向容量瓶中注入液体时,奖容量瓶的玻璃塞倒置在桌面上防止被污染 | |
| B. | 鉴别NO2和溴蒸汽时,将二者分别通到湿润的KI-淀粉试纸上观察颜色变化 | |
| C. | 将甲烷和乙烯的混合气体通入足量溴水,以除去乙烯 | |
| D. | 将洗净的滴定管放到烘箱中烘干,以加快干燥速度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲、乙、丙、丁四种元素均为短周期元素 | |
| B. | 元素丁形成的化合物比元素乙形成的化合物少 | |
| C. | 气态氢化物的稳定性比较:甲>乙 | |
| D. | 最高价氧化物对应水化物的酸性比较:甲<丙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com