
 的催化氧化
的催化氧化| △ |
| △ |
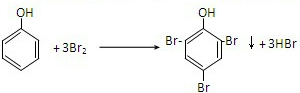 ,故答案为:
,故答案为: ;
;| 醇 |
| △ |
| 醇 |
| △ |
| △ |
| △ |
| 铜或银 |
| 加热 |
| 铜或银 |
| 加热 |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NA个N2分子与NA个CO分子的质量比为1:1 |
| B、水的摩尔质量等于NA个水分子的相对分子质量之和 |
| C、1 mol O2的质量等于NA个氧原子的质量 |
| D、分别由NA个水分子组成的冰、水、水蒸气的质量各不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cr、NH3、H2O |
| B、Cr2O3、N2、H2O |
| C、Cr2O3、NH3、H2O |
| D、CrO3、N2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、标准状况下,密度为dg/L的某气体纯净物一个分子的质量为
| ||
| B、1 mol FeCl3跟水反应完全转化成氢氧化铁胶体后,生成胶体粒子的数目为NA | ||
| C、31g白磷分子中,含有的共价单键数目是NA个 | ||
| D、电解CuCl2溶液时,若有NA个电子通过,则阴极增重64g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ |
| B、在pH=2的溶液中:ClO-、SO32-、Na+、K+ |
| C、含有CO32-的澄清透明溶液中:K+、C6H5O-、Cl-、Na+ |
| D、能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COOO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、给试管中的液体加热时,为防止液体喷出,不能将试管口对着别人,但可以朝向自己 |
| B、取用金属钠时,为防止药品污染,切不可将剩余的钠放回原瓶 |
| C、稀释浓硫酸时,先向量筒中加入一定量的蒸馏水,然后缓缓注入适量浓硫酸,并不断搅拌 |
| D、测定某电解质溶液的pH时,用干燥洁净的玻璃棒蘸取待测溶液滴在pH试纸中心 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某混合溶液中可能含有的离子如下表所示:
某混合溶液中可能含有的离子如下表所示:| 可能大量含有的阳离子 | H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO2- |
| Cl2的体积(标准状况) | 5.6L | 11.2L | 22.4L |
| n(Cl-) | 2.5mol | 3.0mol | 4.0mol |
| n(Br-) | 3.0mol | 2.8mol | 1.8mol |
| n(I-) | x mol | 0 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com