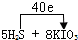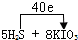己知还原性:H2S>I2,下列6种物质:H2S、K2SO4、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,请回答下列问题:
(1)反应物中发生氧化反应的物质是______(填化学式),被还原的元素是______.
(2)将这6种物质填入下面横线上,组成一个未配平的化学方程式:______
(3)请将氧化剂、还原剂的化学式及配平后的系数填入下列相应的位置中,并标出电子转移的方向与数目:
______+______,______
(4)反应中l mol氧化剂______(填“得到”或“失去”)______mol电子.
解:(1)还原性:H
2S>I
2,则反应中S元素的化合价升高,H
2S为还原剂,还原剂被氧化发生氧化反应,I元素的化合价降低,元素的化合价降低被还原,
故答案为:H
2S;+5价的I;
(2)反应为为H
2S、KIO
3,其余为生成物,该反应为H
2S+KIO
3→K
2SO
4+I
2+H
2SO
4+H
2O,故答案为:H
2S+KIO
3→K
2SO
4+I
2+H
2SO
4+H
2O;
(3)由电子守恒及质量守恒定律可知,反应为5H
2S+8KIO
3═4K
2SO
4+4I
2+H
2SO
4+4H
2O,S元素由-2价升高为+6价,反应中转移40e
-,电子转移的方向与数目为
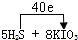
,
故答案为:5H
2S;8KIO
3;
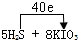
;
(4)KIO
3为氧化剂,I元素由+5价降低为0,1mol氧化剂得到的电子为1mol×(5-0)=5mol,故答案为:得到;5.
分析:(1)还原性:H
2S>I
2,则S元素的化合价升高,I元素的化合价降低,还原剂被氧化发生氧化反应,元素的化合价降低被还原;
(2)反应为为H
2S、KIO
3,其余为生成物;
(3)S元素由-2价升高为+6价,反应中转移40e
-;
(4)KIO
3为氧化剂,I元素由+5价降低为0,以此计算.
点评:本题考查氧化还原反应,明确信息中还原性的比较是解答本题的关键,注意元素的化合价变化即可解答,题目难度中等.

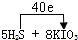 ,
,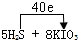 ;
;