
| A. | 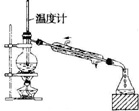 蒸馏石油 | B. | 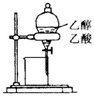 除去乙醇中的乙酸 | ||
| C. | 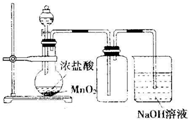 实验室制氯气 | D. | 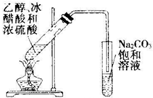 实验室制乙酸乙酯 |
分析 A.温度计测量蒸气温度,冷凝管中下口为进水口、上口为出水口;
B.乙醇和乙酸互溶;
C.浓盐酸和二氧化锰需要加热才能反应;
D.乙酸和碳酸钠反应生成可溶性醋酸钠、乙醇极易溶于水,乙酸乙酯不易溶于碳酸钠溶液.
解答 解:A.利用沸点不同进行蒸馏,所以温度计测量蒸气温度,温度计水银球位于烧瓶支管口处,为防止炸裂冷凝管,冷凝管中下口为进水口、上口为出水口,故A错误;
B.乙醇和乙酸互溶,不分层,不能用分液分离,故B错误;
C.实验室制氯气二氧化锰和浓盐酸需要加热才能反应,故C错误;
D.乙酸和碳酸钠反应生成可溶性醋酸钠、乙醇极易溶于水,乙酸乙酯不易溶于碳酸钠溶液,所以可以采用饱和碳酸钠溶液收集乙酸乙酯,故D正确.
故选D.
点评 本题考查化学实验方案的评价,为高频考点,涉及有机物性质、制备实验及混合物分离提纯等,侧重物质的性质及实验技能的考查,注意实验装置的作用及实验的评价性分析,题目难度不大.


 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:解答题
 ,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.
,该分子中官能团的名称为羧基、羟基,可以和醇类物质发生酯化(或取代)反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为HOOC-CH=CH-COOH.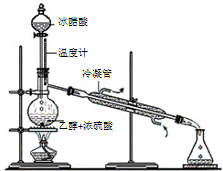

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 | B. | 0.2 | C. | 0.4 | D. | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
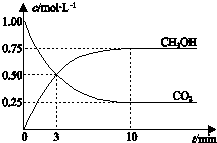
| A. | 升高温度能使$\frac{c(C{H}_{3}OH)}{c(C{O}_{2})}$ 增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
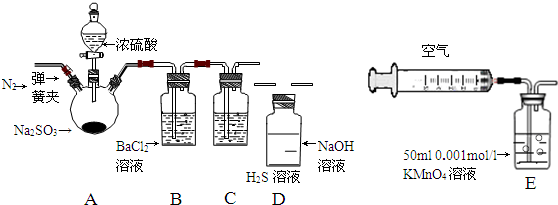
| 实验步骤 | 实验操作 | 预期现象与结论 |
| 1 | 取少量溶液于试管,滴入几滴酚酞 | 溶液变红 |
| 2 | 然后加入足量的BaCl2溶液 | 溶液中产生白色沉淀,最后若红色褪去,则说明①正确;若红色不能褪去,则说明②正确 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上10月月考化学试卷(解析版) 题型:选择题
已知某可逆反应m A(g)+n B(g) 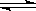 p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
p C(g) △H,在密闭容器中进行,如图表示在不同反应时间t 时温度T和压强P与反应物B在混合气体中的百分含量B%的关系曲线.由曲线分析,下列判断正确的是( )
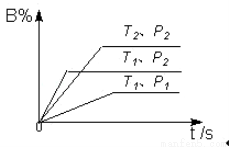
A.T 1<T2,P1>P2,m+n>p,△H<0
1<T2,P1>P2,m+n>p,△H<0
B.T1>T2,P1<P2,m+n>p,△H>0
C.T1<T2,P1>P2,m+n<p,△H<0
D.T1>T2,P1<P2,m+n<p,△H>0
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上月考一化学卷(解析版) 题型:选择题
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:N2 (g)+ 3 H2 (g) = 2 NH3(g) ΔH = - 92.4 KJ/mol,则N≡ N键的 键 能 是
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com