
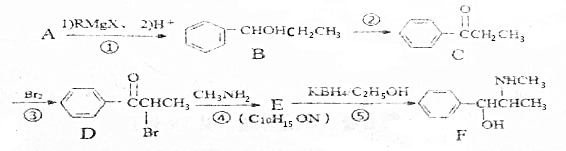
 (R、R′、R″均代表烃基;X代表卤素原子);
(R、R′、R″均代表烃基;X代表卤素原子); .
. .反应⑤的反应类型为还原反应.
.反应⑤的反应类型为还原反应. .
. (写反式结构)
(写反式结构) 分析 A蒸汽密度是相同条件下氢气密度的53倍,则A的相对分子质量为106,根据B的结构和信息①可知,A为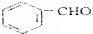 ,
,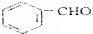 与溴乙烷发生成信息①中的反应生成B,B发生氧化得C,C发生取代得D,根据E的分子式和D的结构简式可知,D发生取代得E,则E为
与溴乙烷发生成信息①中的反应生成B,B发生氧化得C,C发生取代得D,根据E的分子式和D的结构简式可知,D发生取代得E,则E为 ,E发生还原得F,据此答题;
,E发生还原得F,据此答题;
解答 解:A蒸汽密度是相同条件下氢气密度的53倍,则A的相对分子质量为106,根据B的结构和信息①可知,A为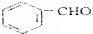 ,
,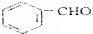 与溴乙烷发生成信息①中的反应生成B,B发生氧化得C,C发生取代得D,根据E的分子式和D的结构简式可知,D发生取代得E,则E为
与溴乙烷发生成信息①中的反应生成B,B发生氧化得C,C发生取代得D,根据E的分子式和D的结构简式可知,D发生取代得E,则E为 ,E发生还原得F,
,E发生还原得F,
(1)根据上面的分析可知,R-H名称为 溴乙烷,A为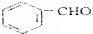 ,A分子中最多有14个原子在同一平面上,
,A分子中最多有14个原子在同一平面上,
故答案为:溴乙烷;14;
(2)根据D的结构简式可知,D中含氧官能团的名称为羰基,E的结构简式为  ,
,
故答案为:羰基; ;
;
(3)反应②的化学方程式为: ,根据上面的分析可知,反应⑤的反应类型为还原反应,
,根据上面的分析可知,反应⑤的反应类型为还原反应,
故答案为: ;还原反应;
;还原反应;
(4)B的消去反应产物为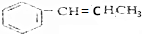 ,
,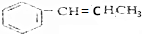 发生加聚反应生成G的结构简式为
发生加聚反应生成G的结构简式为 ,
,
故答案为: ;
;
(5)根据条件:①能与氢氧化钠溶液反应,说明有羧基或酚羟基;②分子中含有两种官能团,则符合条件的C的同分异构体有的结构简式为苯环上连有-OH、-CH2CH=CH2,或-OH、-CH=CHCH3,或-OH、-C(CH3)=CH2,每种都有邻间对三种,所以共有9种,其中苯环上的一氯代物只有两种,则有两个处于对位的基团,且存在顺反异构体,其反式结构为 ,
,
故答案为:9; .
.
点评 本题涉及有机化合物之间的转化关系、官能团及性质、有机反应类型、有条件的同分异构体的书写、有机合成等相关知识,明确有机物的官能团及其性质是解本题关键,难度中等.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 天然气是一种清洁的化石燃料 | |
| B. | 石油通过常压分馏可以得到石油气、汽油、煤油、柴油等 | |
| C. | 煤是由有机物和无机物组成的复杂的混合物 | |
| D. | 石油的裂化、裂解属于化学变化,煤的气化、液化则属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li能在空气中燃烧 | B. | Li2O熔点较低 | ||
| C. | Li2CO3能溶于水 | D. | LiOH受热时易分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铅蓄电池放电时,正极和负极的电极质量均增大 | |
| B. | 反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H<0 | |
| C. | 在N2(g)+3H2(g)?2NH3(g)平衡体系中加入催化剂,N2的反应速率和转化率均增大 | |
| D. | C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃分子中碳原子不可能在同一平面上 | |
| B. | 烷烃易被酸性高锰酸钾溶液氧化 | |
| C. | 在光照条件下,烷烃易与溴水发生取代反应 | |
| D. | 烷烃的卤代反应很难得到纯净的产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | ① | ② | ③ |
| 加入试剂(取等体积溶液) | 0.01mol/LKMnO4 0.1mol/LH2C2O4 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 MnSO4固体 | 0.01mol/LKMnO4 0.1mol/LH2C2O4 Na2SO4固体 |
| 褪色时间/s | 116 | 6 | 117 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
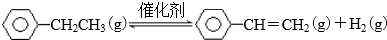
| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/1000kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com