
| A. | 1L0.1 mol•L-1的氨水中含有0.1NA个OH- | |
| B. | 78gNa2O2固体中含有的阴离子数目为2NA | |
| C. | 常温下,23gNO2和N2O4的混合气体含有NA个氧原子 | |
| D. | 常温下,4gCH4中含有4NA个C-H共价键 |
分析 A、一水合氨为弱电解质,在溶液中部分电离;
B、求出过氧化钠的物质的量,然后根据过氧化钠由2个钠离子和1个过氧根构成来分析;
C、NO2和N2O4的最简式均为NO2;
D、求出甲烷的物质的量,然后根据1mol甲烷中含4molC-H 键来分析.
解答 解:A、一水合氨为弱电解质,在溶液中部分电离,故溶液中的氢氧根的个数小于0.1NA个,故A错误;
B、78g过氧化钠的物质的量为1mol,而过氧化钠由2个钠离子和1个过氧根构成,故1mol过氧化钠中含NA个阴离子,故B错误;
C、NO2和N2O4的最简式均为NO2,故23g混合物中含0.5molNO2,故含NA个氧原子,故C正确;
D、4g甲烷的物质的量为0.25mol,而1mol甲烷中含4molC-H 键,故0.25mol甲烷中含NA条C-H键,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:解答题
 .
. 、
、 .
.| 实验操作 | 实验现象 |
| 取KI溶液于试管中,向其中加入少量或适量氯水 向上述溶液中加入CCl4(或加滴淀粉)振荡、静置 (或淀粉-KI溶液或淀粉-KI试纸→必须润湿) 或在淀粉-KI试纸上滴加氯水 | 分层,上层几乎无色,下层紫红色 (试纸变蓝) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. 等.
等.
 为原料制备化合物X(结构简式见图
为原料制备化合物X(结构简式见图 )
)查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做银镜反应后的试管用氨水洗涤 | |
| B. | 做碘升华实验后的烧杯用酒精洗涤 | |
| C. | 盛装苯酚后的试管用盐酸洗涤 | |
| D. | 用KClO3和MnO2制取O2后的试管用水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
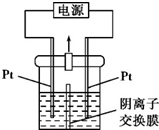 某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI-淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.
“摩尔盐”1(NH4)2Fe(SO4)2•6H2O]是分析化学中的重要试剂.已知:摩尔盐隔绝空气加热至500℃时可完全分解.某学习小组欲探究其分解产物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食盐和味精 | B. | 味精和糖 | C. | 铁粉和硅胶 | D. | 铁粉和碱石灰 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com