
 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g水含有的原子数为NA | |
| B. | 4g金属钙变成钙离子时失去的电子数为0.1NA | |
| C. | 1molO2的质量等于1mol氧原子的质量 | |
| D. | 24gO2和24gO3所含的原子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
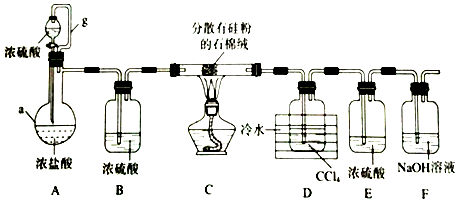
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
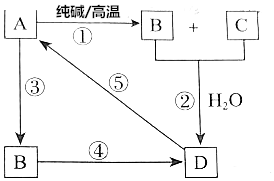 已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.
已知A是一种不溶于水的酸酐.根据如图所示转化关系,请完成下列空白.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
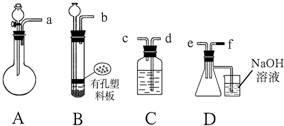
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
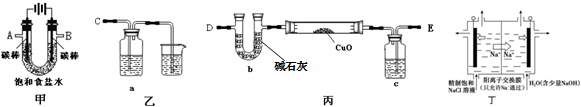
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A溶液 | B溶液 |
| ① | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ② | 2mL 0.1mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液 |
| ③ | 2mL 0.2mol/L H2C2O4溶液 | 4mL 0.01mol/L KMnO4溶液和少量MnSO4 |
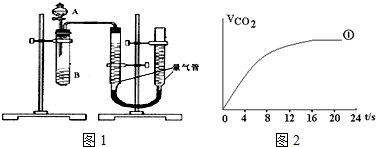
| 实验编号 | 1 | 2 | 3 | 4 |
| 水/mL | 10 | 5 | 0 | X |
| 0.5mol/L H2C2O4/mL | 5 | 10 | 10 | 5 |
| 0.2mol/L KMnO4/mL | 5 | 5 | 10 | 10 |
| 时间/s | 40 | 20 | 10 | --- |
| 时间/s | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26.5 | 27 | 27 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
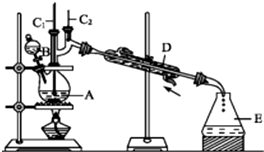 正丁醛是一种化工原料.
正丁醛是一种化工原料.| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com