
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100 g 5.00%的NaOH溶液、足量的CuSO4溶液和100 g 10.00%的K2SO4溶液,电极均为石墨电极。
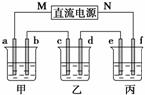
(1)接通电源,经过一段时间后,测得丙中K2SO4质量分数为10.47%,乙中c电极质量增加。据此回答问题:
①电源的N端为________极;
②电极b上发生的电极反应为__________________________________________;
③列式计算电极b上生成的气体在标准状况下的体积:________L;
④电极c的质量变化是__________g;
⑤电解前后各溶液的pH是否发生变化:
甲溶液________________;乙溶液________________;丙溶液________________;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
答案 (1)①正 ②4OH--4e-===2H2O + O2↑
③2.8 ④16 ⑤pH增大 pH减小 pH不变
(2)能继续进行,因为CuSO4溶液已转变为H2SO4溶液,反应也就变为水的电解反应。
解析 (1)①乙中c电极质量增加,则c处发生的反应为Cu2++2e-===Cu,即c处为阴极,由此可推出b为阳极,a为阴极,M为负极,N为正极。丙中电解液为K2SO4溶液,相当于电解水,设电解的水的质量为x g。由电解前后溶质质量相等有,100×10%=(100-x)×
10.47%,得x=4.5 g,故电解的水为0.25 mol。由方程式2H2O 2H2↑+O2↑可知,电解
2H2↑+O2↑可知,电解
2 mol H2O,转移4 mol电子,所以整个反应中转移了0.5 mol电子,而整个电路是串联的,故每个烧杯中的电极上转移的电子数是相等的。②甲中为NaOH溶液,相当于电解水,阳极b处为阴离子OH-放电,即4OH--4e-===2H2O+O2↑。③转移0.5 mol电子,则生成O2为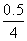 mol=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2 mol×64 g·mol-1=16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4溶液,有电解液即可电解。
mol=0.125 mol,标况下的体积为0.125 mol×22.4 L·mol-1=2.8 L。④Cu2++2e-===Cu,转移0.5 mol电子,则生成的m(Cu)=0.5/2 mol×64 g·mol-1=16 g。⑤甲中相当于电解水,故NaOH的浓度增大,pH变大。乙中阴极为Cu2+放电,阳极为OH-放电,所以H+增多,故pH减小。丙中为电解水,对于K2SO4而言,其pH几乎不变。(2)铜全部析出,可以继续电解H2SO4溶液,有电解液即可电解。


科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.乙醇的官能团是羟基
B.羟基和氢氧根离子的化学式和电子式相同
C.在氧气中燃烧只生成二氧化碳和水的有机物不一定是烃
D.乙醇能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( )。
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥
C.③④⑥ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
钢铁在潮湿的空气中会被腐蚀,发生的原电池反应为2Fe+2H2O+O2===2Fe(OH)2。以下说法正确的是( )
A.负极发生的反应为Fe-2e-===Fe2+
B.正极发生的反应为2H2O+O2+2e-===4OH-
C.原电池是将电能转化为化学能的装置
D.钢柱在水下部分比在空气与水交界处更容易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
为了减少大气污染,许多城市推广汽车使用清洁燃料。目前使用的清洁燃料主要有两类:一类是压缩天然气(CNG);另一类是液化石油气(LPG),这两类燃料的主要成分都是( )
A.碳水化合物 B.碳氢化合物
C.氢气 D.醇类
查看答案和解析>>
科目:高中化学 来源: 题型:
某粒子结构示意图为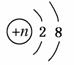 ,若该粒子为离子,则它所带的电荷数可能为( )
,若该粒子为离子,则它所带的电荷数可能为( )
①8-n ②n-8 ③10-n ④n-10
A.①② B.①③
C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚和乙醇是同分异构体,其鉴别可采用化学方法及物理方法,下列鉴别方法中无法达到目的的是( )
A.利用金属钠或者金属钾
B.利用质谱法
C.利用红外光谱法
D.利用核磁共振氢谱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com