
【题目】下列物质中不属于合成材料是( )
A.玻璃B.塑料C.合成橡胶D.合成纤维
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】50 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
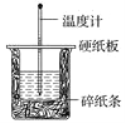
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是________。
(2)烧杯间填满碎纸条的作用是________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值____________(填“偏大”、“偏小”)。
(4)该实验常用0.50 mol·L-1HCl和0.55 mol·L-1NaOH溶液各50 mL进行实验,其中NaOH溶液浓度大于盐酸浓度的作用是________,当室温低于10 ℃时进行实验,对实验结果会造成较大的误差,其原因是______________________________________。
(5)实验中改用60 mL 0.50 mol·L-1盐酸与50 mL 0.50 mol·L-1NaOH溶液进行反应,与上述实验相比,所求得的中和热________(填“相等”或“不相等”),(1分)简述理由: _____________________________。
(6)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热ΔH将________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72—和CrO42—,它们会对人类及生态系统产生很大的危害,必须进行处理。下面是一种处理方法的工业流程:

其中第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
下列说法正确的是( )
A. 反应②中还原1mol Cr2O72—,需要6 mol的Fe2+
B. 改变反应①的平衡体系中c(H+)浓度,溶液颜色无明显变化
C. 若2v (Cr2O72-) =v (CrO42-),说明反应①达平衡状态
D. FeSO4溶液呈酸性的原因是Fe2++ 2H2O ![]() Fe(OH) 2↓+ 2H+
Fe(OH) 2↓+ 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硬水和软水的本质区别是
A.硬水浑浊、软水澄清
B.硬水含有杂质、软水含杂质少
C.硬水是不纯净水,软水是纯净水
D.硬水含有较多可溶性钙镁化合物、软水不含或含少量可溶性钙镁化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”要求从根源上减少或杜绝污染,下列对农作物收割后留下的秸秆的处理方法中,不符合“绿色化学”的是
A.加工成饲料 B.发酵后作农家肥 C.就地焚烧 D.制造沼气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,苯乙烯能与氢气发生加成反应生成乙苯,反应的化学方程式为 ![]() (g)+H2(g)
(g)+H2(g)![]()
![]() (g) △H<0。
(g) △H<0。
(1)上述反应达到平衡后,将容器的容积压缩到原来的一半,其他条件不变。下列说法正确的是 _________(填字母)。
A.v(H2)减小 B.正反应速率加快,逆反应速率減慢
C.反应物转化率增大 D.重新平衡后c(H2)/c(![]() )减小
)减小
(2)若容器容积不变,提出一条能增大![]() 产率的措施:_________________________。
产率的措施:_________________________。
(3)—定温度下,在三个容积均为1.0 L的恒容密闭容器中发生上述反应,相关信息如下表 所示:
容器 | 温度/K | 起始浓度/molL-1 | 平衡浓度/molL-1 | ||
H2 |
|
|
| ||
Ⅰ | 400 | 0.2 | 0.1 | 0 | 0.05 |
Ⅱ | 400 | 0.1 | 0.05 | 0 | |
Ⅲ | 500 | 0.2 | 0.1 | 0 | |
①若容器Ⅰ中反应20 min达到平衡,则H2的平均反应速率为________。
②平衡时,容器Ⅱ中的反应平衡常数为________。
③平衡时,容器Ⅲ中乙苯的浓度________ (填“>”或“<”)0.05。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的装置,打开分液漏斗的活塞,让水滴入锥形瓶中可以看到水浮在硫酸上面且水立即沸腾,硫酸液滴飞溅,同时U形管中甲端下降,乙端上升.这个实验说明了、 , 这个事实告诉我们为了防止发生事故,在稀释浓硫酸时,一定要 . 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com