
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀 | 该溶液中不一定含有SO42- |
| B | 光洁的铁钉放在冷的浓硫酸中,无明显现象 | 铁钉与冷的浓硫酸不反应 |
| C | 将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色 | 氧化性:Br2>Fe3+>I2 |
| D | 向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色 | Ksp(AgCl)<Ksp(AgI) |
| A. | A | B. | B | C. | C | D. | D |
分析 A.该沉淀可能为氯化银,原溶液中不一定含有硫酸根离子;
B.常温下铁与浓硫酸发生钝化现象;
C.能够证明溴单质的氧化性大于铁离子、碘单质,无法判断铁离子与碘单质的氧化性强弱;
D.难溶物越难溶,其溶度积越小.
解答 解:A.向某溶液中加入盐酸酸化的BaCl2溶液,生成白色沉淀,该沉淀可能为AgCl,原溶液中可能含有银离子,不一定含有SO42-,故A正确;
B.光洁的铁钉放在冷的浓硫酸中,常温下发生钝化,阻止了反应的继续进行,故B错误;
C.将少量的溴水分别滴入FeCl2溶液、NaI溶液中,再分别滴加CCl4振荡静置,下层分别呈无色和紫红色,只能证明Br2的氧化性大于Fe3+、I2,无法比较Fe3+、I2的氧化性强弱,故C错误;
D.向浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1~2滴0.01mol•L-1的AgNO3溶液,产生的沉淀呈黄色,说明AgI更难溶,则其溶度积较小,即Ksp(AgCl)>Ksp(AgI),故D错误;
故选A.
点评 本题考查了化学实验方案的评价,题目难度不大,涉及离子检验、氧化还原反应、钝化、难溶物溶度积比较等知识,明确常见元素及其化合物性质即可解答,C为易错点,注意掌握比较氧化性强弱的方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源:2016-2017学年四川省高一上10月月考化学试卷(解析版) 题型:填空题
(1)3 mol二氧化碳气体中,约含有 个二氧化碳分子;2molNH4+中共有 mol电子,与之电子数相等的H2O的质量是 ,这些水若完全电解,产生的氢气在标准状况下的体积为 L。
(2)相同质量的氧气、氢气、二氧化碳中,含有分子数目最少的是 (填化学式,下同),标准状况下体积最大的是 ,原子数最少的是 。
(3)在NaCl与MgCl2的混合液中,Na+与Mg2+的物质的量之比为1:2。如果混合液中共有0.5 mol Cl-,溶液的体积为0.5 L,则混合液中氯化钠的质量为 ;MgCl2的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 200mL | B. | 20mL | C. | 360mL | D. | 36mL |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 假设 | 实验操作 | 现象及结论 |
| 假设1:碳粉可用作还原剂,脱除硝酸盐 | 向烧杯中加入① 碳粉,一段时间后,测定烧杯中NO3-的浓度 | NO3-浓度无明显变化,说明假设Ⅰ不成立 |
| 假设2:碳粉、铁粉形成无数个微小的原电池,促进了硝酸盐的脱除 | 按图示组装实验装置,一段时间后,测定NO3-浓度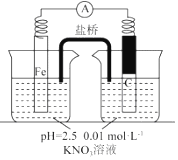 | ② Fe电极部分溶解,电流计指针偏转,说明假设2成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤⑥⑦ | B. | ①②④⑤⑥ | C. | ⑤⑦ | D. | ④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④⑥ | C. | ②④ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2.4g金属镁所含电子数目为0.2NA | |
| B. | 16gCH4所含原子数目为5NA | |
| C. | 17gNH3所含电子数目为10NA | |
| D. | 在常温常压下,11.2LN2含有的分子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com