
某小组为研究电化学原理,设计如图装置.下列叙述不正确的是()

A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
考点: 原电池和电解池的工作原理.
专题: 电化学专题.
分析: A、a和b不连接时,Fe与硫酸铜溶液发生置换反应;铁能将金属铜从其盐中置换出来;
B、原电池中,失电子的极是负极,得电子的极是正极,往往活泼金属做负极;a和b用导线连接时,形成原电池,Fe作负极,Cu作正极;
C、无论a和b是否连接,都发生Fe+Cu2+=Fe2++Cu;铁和硫酸铜可以发生化学反应也可以发生电化学反应;
D、a和b分别连接直流电源正、负极,形成电解池,铁片上发生氧化反应,溶液中铜离子移向阴极;
解答: 解:A、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,所以铁片上会有金属铜析出,故A正确;
B、a和b用导线连接时,形成了原电池,铜作正极,发生的反应为:Cu2++2e﹣=Cu,故B正确;
C、a和b不连接时,铁片和硫酸铜溶液之间发生化学反应,铁能将金属铜从其盐中置换出来,a和b用导线连接时,形成了原电池,加快了铁将金属铜从其盐中置换出来的速度,无论a和b是否连接,铁片均会溶解,溶液从硫酸铜的蓝色逐渐变成硫酸亚铁的浅绿色,故C正确;
D、a和b分别连接直流电源正、负极,电压足够大时,依据电解原理,阳离子移向阴极,所以Cu2+向铁电极移动,故D错误.
故选D.
点评: 本题考查学生化学腐蚀和电化学腐蚀的速率知识,形成原电池能加速化学反应的速率,化学反应与原电池反应,明确原电池的工作原理及所发生的氧化还原反应是解答本题的关键,电解过程的反应原理应用,可以根据所学知识进行回答,难度不是很大.


科目:高中化学 来源: 题型:
原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.
请回答下列问题:
(1)这四种元素中电负性最大的是 (填元素符号)、第一电离能最小的是 (填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是 (填化学式);
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料晶体结构如图1所示,其原子的杂化类型为 ;
(4)D的醋酸盐晶体局部结构如图2,该晶体中含有的化学键是 (填选项序号);
①极性键 ②非极性键 ③配位键 ④金属键
(5)某学生所做的有关D元素的实验流程如下图:
D单质 棕色的烟
棕色的烟 绿色溶液
绿色溶液 蓝色沉淀
蓝色沉淀 蓝色溶液
蓝色溶液 黑色沉淀请书写第⑤反应的离子方程式: .
黑色沉淀请书写第⑤反应的离子方程式: .

查看答案和解析>>
科目:高中化学 来源: 题型:
某未知溶液中已检验出含有离子Ca2+、NO3﹣,且pH=2.欲检验此溶液中是否大量存在以下6种离子:①ClO﹣ ②NH4+③I﹣④Fe2+⑤AlO2﹣⑥Cl﹣,其中不必检验就能排除的离子是( )
A. ②③⑤⑥ B. ①③④⑤ C. ①④⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液中可能含有Na+、Ba2+、Cu2+、CO32﹣、Cl﹣、Mg2+中的一种或几种离子.
①向此溶液中滴加足量稀盐酸无明显现象.
②取少许①的溶液并加入少量的Na2SO4溶液,有白色沉淀产生.
③取②的上层清液并加入足量的NaOH溶液,有白色沉淀产生.
(1)原溶液中一定含有的离子是 ,一定不含有的离子是 ,不能确定是否含有的离子是 .
②中反应的离子方程式为 .
(3)若另取10mL①的溶液于锥形瓶中,然后向此溶液中逐滴加入NaOH溶液(如图甲所示).滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示.

①OA段反应的离子方程式为 .②AB段反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学按图所示的装置进行电解实验.下列说法正确的是()
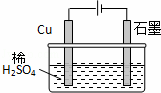
A. 电解过程中,铜电极上有H2产生
B. 电解一定时间后,石墨电极上有H2析出
C. 整个电解过程中,H+的浓度不断增大
D. 电解初期,主反应方程式为:Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水蒸气.已知室温下1g甲硅烷自燃放出热量44.6kJ,其热化学方程式是 .
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1mol Cl2参与反应时释放145kJ的热量,写出这个热化学方程式: .
(3)家用液化气中的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成CO2和液态水时,放出的热量是5×105 kJ,试写出丁烷燃烧的热化学方程式: .丁烷的燃烧热为 kJ•mol﹣1.已知1mol液态水汽化时需要吸收44kJ的热量,则反应:C4H10(g)+ O2(g)═4CO2(g)+5H2O(g)的△H=﹣ kJ•mol﹣1.高温高压催化剂N2(g)+3H2(g) 2NH3(g);△H<0.
O2(g)═4CO2(g)+5H2O(g)的△H=﹣ kJ•mol﹣1.高温高压催化剂N2(g)+3H2(g) 2NH3(g);△H<0.
查看答案和解析>>
科目:高中化学 来源: 题型:
与氨碱法比较,下列关于联合制碱法优点的判断中不正确的是( )
|
| A. | 提高了原料利用率 | B. | 降低了生产成本 |
|
| C. | 减少了环境污染 | D. | 减轻了对设备的腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
.实验室用50mL浓盐酸跟足量的氯酸钾固体共热制取氯气,反应的化学方程式为:KClO3+6HCl(浓) KCl+3Cl2↑+3H2O.(只第(3)题写计算过程)
KCl+3Cl2↑+3H2O.(只第(3)题写计算过程)
(1)浓盐酸在反应中显示出来的性质是 (填写编号).
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(2)若产生0.1mol Cl2,则转移电子的物质的量为 mol.
(3)若反应中HCl的利用率只有50%,当反应结束时,生成Cl20.15mol,求浓盐酸的物质的量浓度.(写计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com