
分析 (1)a.甲:FeCl3溶液中加少量NaOH溶液,反应生成氢氧化铁沉淀;
乙:加热饱和FeCl3溶液,促进氯化铁水解生成氢氧化铁沉淀;
丙:向沸水中加入饱和氯化铁,氯化铁水解生成氢氧化铁胶体;
b.依据丁达尔效应是胶体特有性质解答;
c.胶体本身不带电,胶体吸附离子而形成带电的胶体微粒,在外加电场作用下发生定向移动而产生电泳现象,依据阴极区附近的颜色逐渐变深判断解答;
(2)d.依据C=$\frac{1000ρω}{M}$计算浓硫酸的物质的量浓度;
e.依据配制一定物质的量浓度溶液的一般步骤选择仪器;
f.配制操作定容时,眼睛俯视,导致溶液体积偏小,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)a.甲:FeCl3溶液中加少量NaOH溶液,反应生成氢氧化铁沉淀,不能得到氢氧化铁胶体;
乙:加热饱和FeCl3溶液,促进氯化铁水解生成氢氧化铁沉淀,不能得到氢氧化铁胶体;
丙:向沸水中加入饱和氯化铁,氯化铁水解生成氢氧化铁胶体;
故选:丙;
b.丁达尔效应是胶体特有性质,可以用一束光照射得到的液体,从侧面观察看到一条光亮的“通路”,及产生丁达尔效应即可证明为胶体;
故答案为:用一束光照射得到的液体,从侧面观察看到一条光亮的“通路”;
c.胶体本身不带电,胶体吸附离子而形成带电的胶体微粒,在外加电场作用下发生定向移动而产生电泳现象,依据阴极区附近的颜色逐渐变深,可知氢氧化铁胶体微粒带正电;
故答案为:正;
(2)d.98% (ρ=1.84g/cm3)的硫酸,物质的量浓度C=$\frac{1000×1.84×98%}{98}$=18.4mol/L;
故答案为:18.4;
e.配制一定物质的量浓度溶液的一般步骤:计算、量取、稀释、移液、定容、摇匀、装瓶,用到的仪器:量筒、烧杯、玻璃棒、容量瓶、胶头滴管,配制配制6.0mol/L的H2SO4溶液950mL,应选择1000mL容量瓶,所以还需要的仪器:1000mL容量瓶;
故答案为:1000mL容量瓶;
f.配制操作定容时,眼睛俯视,导致溶液体积偏小,依据C=$\frac{n}{V}$可知溶液浓度偏大;
故答案为:偏大.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及使用方法,题目难度不大.


科目:高中化学 来源: 题型:填空题
| 主食 | 米饭、馒头 |
| 副食 | 烧鸡块、咸鸭蛋、红烧肉、花生米 |
| 饮料 | 牛奶 |
| 你的补充 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24LNO与1.12L O2混合后的分子数小于0.1NA | |
| B. | 1L0.1mol•L-1的氨水含有0.1NA个OH- | |
| C. | 6.8g液态KHSO4中含有0.1NA个阳离子 | |
| D. | 1molFe与1molCl2充分反应,转移3NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 未冷却就转移、定容 | B. | 容量瓶原有少量蒸馏水 | ||
| C. | 定容时俯视刻度线观察液面 | D. | 量筒取浓盐酸时,俯视读数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)
某溶液中含有Ba2+,Mg2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离.其流程图如图(已知溶液2为无色溶液)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
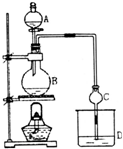 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中盛有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com