
 ,判断下列物质不能与B发生化学反应的有C.
,判断下列物质不能与B发生化学反应的有C.分析 将有色气体单质A通入到淀粉碘化钾溶液中,观察到溶液颜色先呈现蓝色,最后蓝色又褪去呈现无色,说明是强氧化性气体,先氧化碘离子为碘单质,继续氧化碘单质为碘酸钾,若在碘单质上直接通入气体A至生成物完全液化,得原子个数比为1:1的红棕色液体B,其化学性质与其组成元素的单质相似为卤素互化物,判断有色气体为氯气;
B为卤素互化物ICl,形成的是共价键,性质和氯气性质相似,依据氯气具有的性质判断.
解答 解:将有色气体单质A通入到淀粉碘化钾溶液中,观察到溶液颜色先呈现蓝色,最后蓝色又褪去呈现无色,说明是强氧化性气体,先氧化碘离子为碘单质,继续氧化碘单质为碘酸钾,若在碘单质上直接通入气体A至生成物完全液化,得原子个数比为1:1的红棕色液体B,其化学性质与其组成元素的单质相似为卤素互化物,判断有色气体A为氯气,
(1)组成气体A的元素在周期表中的位置第三周期ⅦA族,
故答案为:第三周期ⅦA族;
(2)B为卤素互化物ICl,形成的是共价键,电子式为: ,性质和氯气性质相似,依据氯气具有的性质判断,氯气具有氧化性,所以ICl也具有氧化性,和水反应生成氯化氢和碘化氢,和乙烯发生加成反应,氧化二氧化硫为硫酸,与硫酸钠溶液不反应,
,性质和氯气性质相似,依据氯气具有的性质判断,氯气具有氧化性,所以ICl也具有氧化性,和水反应生成氯化氢和碘化氢,和乙烯发生加成反应,氧化二氧化硫为硫酸,与硫酸钠溶液不反应,
故答案为: ;C;
;C;
(3)溶液蓝色褪去的原因是氯气氧化碘单质为碘酸钾,反应的离子方程式为5Cl2+I2+6H2O=2IO3-+10Cl-+12H+,故答案为:5Cl2+I2+6H2O=2IO3-+10Cl-+12H+.
点评 本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和推断能力的考查,注重于元素化合物知识的综合运用,注意“题眼”的确定,准确确定“题眼”是解推断题的关键,难度不大.


科目:高中化学 来源: 题型:填空题
| 序号 | 符合的条件 | 物质的化学式或名称 |
| (1) | 混合物 | |
| (2) | 电解质,但熔融状态下并不导电 | |
| (3) | 电解质,但难溶于水 | |
| (4) | 非电解质 | |
| (5) | 既不是电解质,也不是非电解质,但本身能导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除③外 | B. | 除③⑤外 | C. | 除③④外 | D. | 除⑥外 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仍平衡 | B. | 盛钠的一端下沉 | C. | 盛镁的一端下沉 | D. | 不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
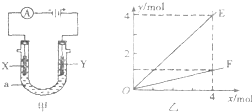 电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )
电解原理在化学工业中有着广泛的应用.图甲表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.则下列说法不正确的是( )| A. | 若此装置用于电解精炼铜,则X为纯铜、Y为粗铜,电解的溶液a可以是硫酸铜或氯化铜溶液 | |
| B. | 按图甲装置用惰性电极电解AgN03溶液,若图乙横坐标x表示流入电极的电子的物质的量,则E可表示反应生成硝酸的物质的量,F表示电解生成气体的物质的量 | |
| C. | 按图甲装置用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,加入0.5mol的碳酸铜刚好恢复到通电前的浓度和pH,则电解过程中转移的电子为2.0 mol | |
| D. | 若X、Y为铂电极.a溶液为500 mL KCl和KNO3的混合液,经过一段时间后,两极均得到标准状况下11.2 L气体,则原混合液中KCl的物质的量浓度至少为2.0 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.
短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛.| X | Y | Z | |
| W |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
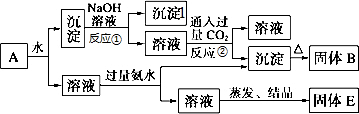
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com