
| A. | 二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率减小 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以增大生成氢气的速率 | |
| C. | N2(g)+3H2(g)=2NH3(g)达到平衡后,增大c(N2)平衡向右移动,N2的转化率增大 | |
| D. | 汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大反应速率 |
分析 A.升温对反应速率的影响是增大反应速率,正逆反应速率都增大;
B.常温下浓硫酸和铁发生钝化现象,阻止反应进行;
C.两种反应物增大其中一种物质的量,会增大另一种物质转化率,本身转化率降低;
D.催化剂改变反应速率,不改变化学平衡;
解答 解:A.二氧化硫的催化氧化是一个放热反应,升高温度,正反应速率增大,故A错误;
B.常温下浓硫酸和铁发生钝化现象,阻止反应进行,浓硫酸和铁不能生成氢气,故B错误;
C.N2(g)+3H2(g)=2NH3(g)达到平衡后,增大c(N2)平衡向右移动,N2的转化率减小,故C错误;
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,加入催化剂加快化学反应速率,故D正确;
故选D.
点评 本题考查了化学平衡影响因素、物质性质的理解、化学平衡移动原理的熟练掌握是解题关键,题目较简单.


科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
对于可逆反应 2AB3(g) A2(g)+3B2(g)(正反应为吸热),下列图象正确的是( )
A2(g)+3B2(g)(正反应为吸热),下列图象正确的是( )
A.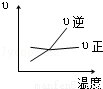 B.
B.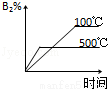 C.
C.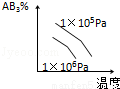 D.
D.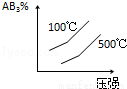
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A. 原子半径:A<B<C<D<E
B. 金属性:D>C
C. 一定条件下,元素C、D的最高价氧化物对应的水化物之间能发生反应
D. 化合物AE与CE含有相同类型的化学键
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列颜色不属于因化学反应而产生的现象的是
A.无色试剂瓶中的浓硝酸呈黄色
B.久置的KI溶液呈黄色
C.新制氯水久置后变为无色
D.在普通玻璃导管口点燃纯净氢气时,火焰呈黄色
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加硫氰化钾溶液 | |
| B. | 取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,逐滴滴入氢氧化钠溶液直至足量 | |
| D. | 取样,加足量盐酸加热,湿润的品红试纸检验气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/mol•L-1 | 0.08 | 0.14 | 0.18 | 0.2 | 0.2 | 0.2 |
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的pH试纸测稀碱液的pH,测定值偏大 | |
| B. | 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小 | |
| C. | 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小 | |
| D. | 测定中和反应反的应热时,将碱缓慢倒入酸中,所测温度值偏大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com