
A.+3 B.+
科目:高中化学 来源: 题型:
| 主族 周期 |
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |




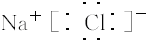
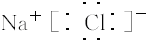
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2013届上海市高二上学期期中考试化学试卷 题型:填空题
根据元素周期表和元素周期律知识,完成下来填空:
(1)某元素的原子L层电子数比K层电子数多3个,该元素位于元素周期表中第 周期,与该元素同一主族的短周期元素是 。
(2)硫元素的非金属性比氯元素的非金属性 (选填“强”、“弱”),能说明这一事实的化学方程式是 (任写一个)。
(3)关于氟、钠、镁、氯四种元素的性质递变规律,描述正确的是 (填写编号)。
(A)、 原子半径:Na<Cl (B)、离子半径:F-<Mg2+
(C)、 热稳定性:HF>HCl (D)、碱性:NaOH> Mg(OH)2
查看答案和解析>>
科目:高中化学 来源:2012-2013学年上海市松江二中高二(上)期中化学试卷(解析版) 题型:填空题
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 1 | H | |||||||
| 2 | D | E | F | |||||
| 3 | A | B | C | G |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com