
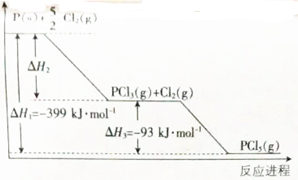
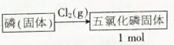

分析 (1)由图可知$\frac{5}{2}$Cl2(g)+P(s)═PCl5(g)△H1=-399KJ/mol,Cl2(g)+PCl3(g)═PCl5(g)△H3=-93KJ/mol,根据盖斯定律,求解;
(2)①2mol PCl5(s)时的能量变化,应等于2mol三氯化磷的焓变和2mol氯气的焓变之和;
②根据盖斯定律,反应焓变只与起始和终了物质有关,和变化过程无关;
(3)五氯化磷与水剧烈反应生成两种酸,可知是磷酸和盐酸,所以五氯化磷与足量烧碱溶液反应是先与水反应生成的磷酸和盐酸再与氢氧化钠发生中和反应,由此书写化学方程式.
解答 解:(1)由图可知$\frac{5}{2}$Cl2(g)+P(s)═PCl5(g)△H1=-399KJ/mol,Cl2(g)+PCl3(g)═PCl5(g)△H3=-93KJ/mol,根据盖斯定律,所以Cl2(g)+P(s)═PCl3(g)△H=△H1-△H3=-399KJ/mol-(93KJ/mol)=-306KJ/mol,故答案为:Cl2(g)+P(s)═PCl3(g)△H=△H1-△H3=-399KJ/mol-(93KJ/mol)=-306KJ/mol;
(2)①2mol PCl5(s)时的能量变化,应等于2mol三氯化磷的焓变和2mol氯气的焓变之和,所以要计算生成2mol PCl5(s)时的能量变化,必须知道三氯化磷和氯气反应的焓变这两个物理量,故答案为:三氯化磷和氯气反应的焓变;
②根据盖斯定律,反应焓变只与起始和终了物质有关,和变化过程无关,反应物和生成物的物质的量相等,状态相同,所以方案1的△H和方案2的△H相等,故答案为:=,反应物制备生成物,反应焓变只与起始和终了物质有关,和变化过程无关;
(3)五氯化磷与水剧烈反应生成两种酸,可知是磷酸和盐酸,所以五氯化磷与足量烧碱溶液反应是先与水反应生成的磷酸和盐酸再与氢氧化钠发生中和反应,方程式为:PCl5+8NaOH=Na3PO4+5NaCl+4H2O,故答案为:PCl5+8NaOH=Na3PO4+5NaCl+4H2O.
点评 本题考查了盖斯定律的应用和五氯化磷水解的相关知识,而对五氯化磷水解可以视为先与水反应,生成的酸再与碱反应,题目难度中等.


科目:高中化学 来源: 题型:选择题

| A. | 图①表示25℃时,向盐酸和醋酸混合溶液中滴入氨水过程中电导率(表征溶液导电能力大小的物理量)的变化关系 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.
实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式
;写出它与原子半径最小的原子形成10电子且为正四面体结构的化合物的电子式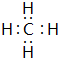 ,用电子式表示⑤和⑧形成化合物的过程
,用电子式表示⑤和⑧形成化合物的过程 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a、b、c | B. | d、e | C. | b、d、e | D. | b、c、d、e |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固体硫酸钠不能导电,所以硫酸钠是非电解质 | |
| B. | 在NaOH溶液中除了Na+、OH-外,不存在其它粒子 | |
| C. | NaOH溶液能导电,所以NaOH溶液是电解质 | |
| D. | CO2、SO2、SO3、NH3等均属于非电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com