分析:(1)小苏打变质后生成的杂质是碳酸钠,因此检验是否变质即检验是否存在碳酸根离子,据此进行分析解答;
A.澄清石灰水跟二者都能反应,现象都是白色沉淀生成,无法区别是否含有碳酸钠;
B.碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠;
C.碳酸钠和碳酸氢钠与盐酸反应生成二氧化碳和水,无法区别是否含有碳酸钠;
(2)方案一:该方案原理为在加热的条件下Na
2CO
3能够稳定存在,而NaHCO
3较易发生如下的分解反应2NaHCO
3=Na
2CO
3+CO
2↑+H
2O,从而可根据其反应产生的CO
2和水蒸汽H
2O的量或残留的固体的量推算出小苏打样品中纯碱的质量分数.该方案根据加热后残渣的质量来求解,方案关键是要加热至恒重,以保证NaHCO
3全部分解,碳酸氢钠不稳定,受热易分解,分解反应通常为吸热反应;
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na
2CO
3+H
2SO
4=H
2O+CO
2↑+Na
2SO
4、2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.方案关键是要获得产生的CO
2的质量.
①通过反应生成气体检验小苏打是否变质,防止装置漏气,首先须检查装置的气密性;
②盐酸易挥发,硫酸难挥发,据此分析判断;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;根据Na
2CO
3+H
2SO
4=H
2O+CO
2↑+Na
2SO
4、2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑列式求解;
方案三:该方案原理为在样品中加入BaCl
2溶液,其中Na
2CO
3可与BaCl
2发生反应Na
2CO
3+BaCl
2=BaCO
3↓+2NaCl,而NaHCO
3与BaCl
2则不反应.从而根擗产生的沉淀量,得出纯碱的质量分数.方案关键是测定BaCO
3沉淀的质量,自然要保证沉淀完全,要正确过滤好.
①根据过滤具体操作判断所需仪器;
②试验中判断沉淀是否完全的方法是:取少量滤液,再滴加BaCl
2溶液少许,如无白色沉淀出现,说明沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na
2CO
3+BaCl
2═BaCO
3↓+2NaCl,产生BaCO
3沉淀,根据样品的总量和生成BaCO
3沉淀的量结合2NaHCO
3Na
2CO
3+H
2O+CO
2↑,就可得出原小苏打的质量;
解答:
解:(1)小苏打的成分为碳酸氢钠,小苏打变质分解为碳酸钠,因此检验是否变质即检验是否存在碳酸根离子,
A.澄清石灰水跟二者都能反应,Ca(OH)
2+Na
2CO
3═CaCO
3↓+2NaOH,Ca(OH)
2+NaHCO
3═CaCO
3↓+NaOH+H
2O均生成白色沉淀,无法区别是否含有碳酸钠,故A错误;
B. 碳酸氢钠与氯化钙不反应,碳酸钠与氯化钙反应Na
2CO
3+CaCl
2=CaCO
3↓+2NaCl生成碳酸钙沉淀,可鉴别小苏打是否已经变质,故B正确;
C.碳酸氢钠中无论是否含有碳酸钠,逐滴滴加稀盐酸,都有二氧化碳气体生成,无法鉴别,故C错误;
故选B.
(2)方案一:称取一定质量的样品,置于坩埚中加热至恒重,以保证NaHCO
3全部分解,发生的化学反应方程式为:2NaHCO
3Na
2CO
3+H
2O+CO
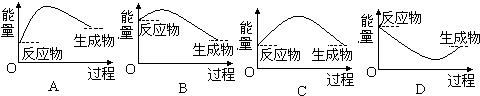
2↑,分解反应通常为吸热反应,该反应为分解反应为吸热反应,反应中生成物总能量高于反应物总能量,需从外界吸收能量贮存,故A符合,
故答案为:2NaHCO
3Na
2CO
3+H
2O+CO
2↑;A;
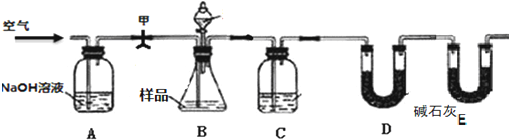
方案二:打开弹簧夹甲,缓缓通入空气进入装置A中,二氧化碳被氢氧化钠吸收,剩余气体通过各装置排净装置中的二氧化碳,避免干扰实验,打开B的分液漏斗滴加酸反应,装置B中发生Na
2CO
3+H
2SO
4=H
2O+CO
2↑+Na
2SO
4、2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑,C中为浓硫酸吸收水,干燥二氧化碳,利用D装置吸收二氧化碳,E装置防止空气中的二氧化碳、水进入D装置干扰含量测定.
①通过反应生成气体的量检验小苏打是否变质,为了保证实验的成功,首先须检查装置的气密性,
故答案为:检查装置的气密性;
②该实验通过D装置吸收二氧化碳的量测定小苏打是否变质,盐酸易挥发,如用盐酸,生成的二氧化碳中混有氯化氢,影响测定结果,所以分液漏斗中应该装硫酸,
故答案为:硫酸;
⑤E装置的作用是防止空气中的水蒸气、二氧化碳进入D被吸收;步骤⑤中还要再通空气,将装置B、C中的二氧化碳全部排入D中;
设19.0g样品中NaHCO
3和Na
2CO
3的物质的量分别为x、y,则
Na
2CO
3+H
2SO
4=H
2O+CO
2↑+Na
2SO
4、2NaHCO
3+H
2SO
4=Na
2SO
4+2H
2O+2CO
2↑
x x y y
解得x=0.1mol,则样品中Na
2CO
3的质量分数
×100%≈55.8%,
故答案为:55.8%;
方案三:①过滤操作中,除了烧杯、漏斗外还用到玻璃棒引流,
故答案为:玻璃棒;
②试验中判断沉淀是否完全的方法是:取上层清液,再滴加BaCl
2溶液少许,如无白色沉淀出现,说明沉淀完全,
故答案为:取上层清液中滴加氯化钡溶液,如无沉淀生成则沉淀完全;
③在一定量样品中加入足量氯化钡溶液,碳酸氢钠与氯化钡不反应,碳酸钠和氯化钡此时发生如下反应:Na
2CO
3+BaCl
2═BaCO
3↓+2NaCl,产生BaCO
3沉淀,干燥得沉淀质量为19.7g,n(BaCO
3)=
=
=0.1mol,n(BaCO
3)=n(Na
2CO
3),碳酸钠的质量为m(Na
2CO
3)=nM=0.1mol×106g/mol=10.6g,则样品中m(NaHCO
3)=19g-10.6g=8.4g,则原样品中转变为碳酸钠的原小苏打n(NaHCO
3)=2n(Na
2CO
3)=0.2mol,质量应为m(NaHCO
3)=nM=0.2mol×84g/mol=16.8g,则样品中原小苏打的质量应为16.8g+8.4g=25.2g,
故答案为:25.2g;



 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案 工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:
工业合成氨时将N2和H2按体积比为1:3通入合成塔中,在不同条件下达到平衡时,混合物中NH3的含量(体积分数)如下表:

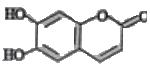 中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )
中药狼把草的成分之一M具有清炎杀菌作用,M的结构如右图所示:下列叙述正确的是( )