
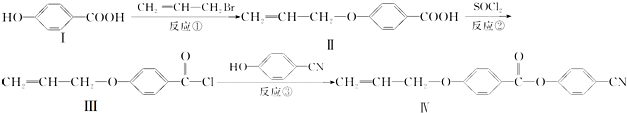
 .
. 也可与化合物Ⅲ发生类
也可与化合物Ⅲ发生类 .
.分析 (1)根据有机物的结构简式判断含有的元素种类和原子个数,可确定分子式,能与NaOH反应的官能团为酚羟基和羧基;
(2)氯代烃在碱性条件下水解生成-OH;
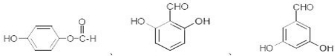
(3)苯环上一溴代物只有2种,说明只有两种不同的位置,结构应对称,且能发生银镜反应,说明应含有-CHO;
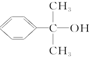
(4)化合物 与III发生取代反应生成-COO-和水;
与III发生取代反应生成-COO-和水;
(5)化合物Ⅳ含有C=C,可发生加成、加聚反应,不含酚羟基,含有酯基,可发生水解反应.
解答 解(1)由结构简式可知化合物Ⅰ中含有7个C、6个H、3个O,则分子式为C7H6O3,化合物Ⅰ含有酚羟基和羧基,都具有酸性,能与NaOH发生反应,则2mol化合物Ⅰ最多可与4molNaOH反应,
故答案为:C7H6O3;4;
(2)氯代烃在碱性条件下水解生成-OH,CH2=CH-CH2Br与NaOH水溶液反应的化学方程式为CH2=CHCH2Br+NaOH$\stackrel{△}{→}$CH2=CHCH2OH+NaBr,
故答案为:CH2=CHCH2Br+NaOH$\stackrel{△}{→}$CH2=CHCH2OH+NaBr;
(3)苯环上一溴代物只有2种,说明只有两种不同的位置,结构应对称,且能发生银镜反应,说明应含有-CHO,则可能的结构有 ,
,
故答案为: ;
;
(4)由官能团的转化可知反应③属于取代反应,化合物 与III发生取代反应生成-COO-,反应物为
与III发生取代反应生成-COO-,反应物为 ,
,
故答案为:取代; ;
;
(5)A.含有O、N等元素,属于烃的衍生物,故A错误;
B.不含有酚羟基,则不能与FeCl3溶液反应显紫色,故B错误;
C.含有C=C,则一定条件下能发生加聚反应,故C正确;
D.含有C=C,可与溴发生加成反应而使溴的四氯化碳溶液褪色,故D正确.
故答案为:CD.
点评 本题考查有机物的合成,解答本题的关键是能正确把握有机物官能团的性质,注意根据官能团的转化判断反应类型,易错点为同分异构体的书写,注意体会.


科目:高中化学 来源: 题型:解答题
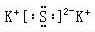 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
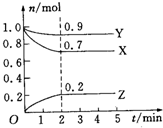 某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )
某温度时,在2L密闭容器中,X、Y、Z三种气体物质的量随时间变化的曲线如图所示,下列说法中不正确的是( )| A. | 该反应的化学方程式为3X+Y?2Z | |
| B. | 反应到达平衡状态时,X的转化率为70% | |
| C. | 反应开始到2min,Z的平均反应速率为0.05mol•L-1•min-1 | |
| D. | 为提高X的转化率,可适当增加Y的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
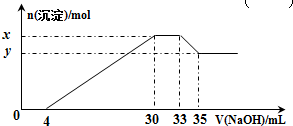
| A. | x与y的差值为0.1 mol | B. | 原溶液中c(Cl-)=0.75 mol•L-1 | ||
| C. | 原溶液的pH=1 | D. | 原溶液中n(Mg2+):n(Al3+)=5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
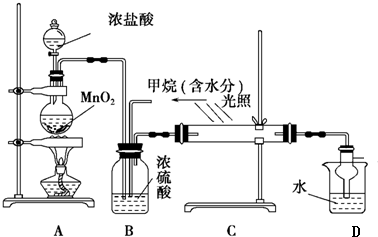
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构式:CH2═CH2 | B. | Na2O的电子式: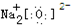 | ||
| C. | K+的电子排布式:1S22S22P63S23P6 | D. | 硝酸钾的分子式:KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
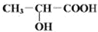 已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题:
已知有机物中若含有相同的官能团,则化学性质相似.完成下列问题: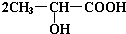 +Na2CO3→
+Na2CO3→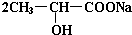 +H2O+CO2↑.
+H2O+CO2↑.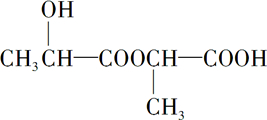 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com