
| A. | 氯化氢是强电解质,醋酸是弱电解质,盐酸溶液的导电性一定强于醋酸溶液 | |
| B. | 不论是浓硝酸还是稀硝酸,与铜反应均体现出硝酸的酸性和强氧化性 | |
| C. | SO2、NO、NO2都是形成酸雨的因素,都能和水反应生成酸 | |
| D. | 氯元素的非金属性强于碳元素,氯元素含氧酸的酸性都大于碳元素的含氧酸的酸性 |
分析 A.溶液的导电性强取决于自由移动离子浓度的大小和带电荷数;
B.依据硝酸与铜反应中氮元素化合价变化判断解答;
C.一氧化氮不溶于水;
D.比较非金属性强弱应看非金属元素最高价氧化物对应水化物酸性强弱.
解答 解:A.氯化氢是强电解质,醋酸是弱电解质,但是盐酸溶液的导电性不一定强于醋酸溶液,因为溶液的导电性强取决于自由移动离子浓度的大小和带电荷数,故A错误;
B.铜与浓硝酸反应,生成硝酸铜和二氧化氮、水,与稀硝酸反应生成硝酸铜、一氧化氮和水,两个反应中硝酸部分氮元素化合价降低,表现为氧化性,部分化合价不变(生成硝酸铜)表现硝酸的酸性,故B正确;
C.一氧化氮不溶于水,与水不反应,故C错误;
D.氯元素的非金属性强于碳元素,则高氯酸酸性强于碳酸,但是次氯酸酸性弱于碳酸,故D错误;
故选:B.
点评 本题为综合题,考查了电解质强弱判断及导电性强弱影响因素,氧化还原反应基本概念,元素非金属性强弱判断依据,题目综合性强,明确相关概念及物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
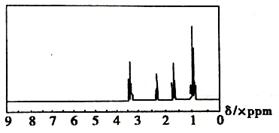
| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. | CH3CH2CH2CH3 | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 目前加碘食盐中含碘元素的物质主要是KIO3 | |
| B. | 维生素C具有还原性,可用作食品抗氧化剂 | |
| C. | 向含有Hg2+的废水中加入Na2S,使Hg2+转化成HgS沉淀除去 | |
| D. | 淀粉、油脂和蛋白质都是天然高分子化合物,都能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苏打--NaHCO3 | B. | 醋酸--C2H5OH | C. | 明矾-KAl(SO4)2 | D. | 生石灰-CaO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl的电子式: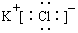 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 中子数为117,质子数为78 的铂原子:${\;}_{117}^{195}Pt$ | |
| D. | K+的结构示意图: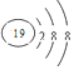 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚊虫叮咬处涂抹肥皂水可止痛痒 | |
| B. | 大力实施矿物燃料脱硫脱硝技术,能减少硫、氮氧化物的排放 | |
| C. | 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用 | |
| D. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
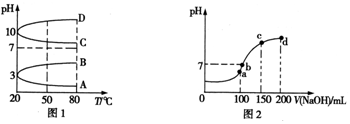
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
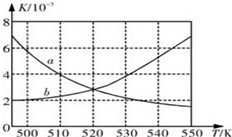 Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)
Ⅰ:为了减少CO的排放,某环境研究小组以CO和H2 为原料合成清洁能源二甲醚(DME),反应如下:4H2(g)+2CO(g)| 时间/min | 0 | 20 | 40 | 80 | 100 |
| n(H2)/mol | 2.0 | 1.4 | 0.85 | 0.4 | - |
| n(CO)/mol | 1.0 | - | 0.425 | 0.2 | 0.2 |
| n(CH3OCH3)/mol | 0 | 0.15 | - | - | 0.4 |
| n(H2O)/mol | 0 | 0.15 | 0.2875 | 0.4 | 0.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com