
NO2��N2O4���ת��:2NO2(g) N2O4(g)����H<0�ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ1 L�ĺ����ܱ�������,��Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵������ȷ����(����)
N2O4(g)����H<0�ֽ�һ����NO2��N2O4�Ļ������ͨ�����Ϊ1 L�ĺ����ܱ�������,��Ӧ��Ũ����ʱ��仯��ϵ��ͼ������˵������ȷ����(����)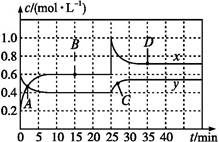
A.ͼ�й�����������x��y,��������y��ʾNO2Ũ����ʱ��ı仯
B.A��B��C��D�ĸ�����,��ʾ��ѧ��Ӧ����ƽ��״̬�ĵ���B��C
C.��Ӧ������25 minʱ,���߷����仯��ԭ���Ǽ���0.4 mol N2O4
D.��Ҫ�ﵽ��D��ͬ��״̬,��25 minʱ���ɲ�ȡ�Ĵ�ʩ���ʵ���С�������
 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��2mol H2��1mol CO2�������Ϊ10L�ĺ����ܱ������У���һ�������·�����Ӧ��
��CO2(g)+ H2(g) CO(g) + H2O(g) ��H1����41.2kJ��moL��1��
CO(g) + H2O(g) ��H1����41.2kJ��moL��1��
��CO2(g)+ 3H2(g) CH3OH(g) + H2O(g) ��H2����49kJ��moL��1��
CH3OH(g) + H2O(g) ��H2����49kJ��moL��1��
��Ӧ100min��ﵽƽ�⣬����±����ݣ�
| �¶� | ת���ʣ�%�� | ���ʵ�����mol�� | ||
| H2 | CO2 | CH3OH | CO | |
| 240�� | | 10 | 0.05 | 0.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
һ�������£�ͨ�����з�Ӧ��ʵ��ȼú��������Ļ��գ�
SO2(g)��2CO(g)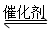 2CO2(g)��S(l)����H��0
2CO2(g)��S(l)����H��0
����Ӧ�ں��ݵ��ܱ������н��У������й�˵����ȷ����(����)
| A��ƽ��ǰ�����ŷ�Ӧ�Ľ��У�������ѹǿʼ�ղ��� |
| B��ƽ��ʱ�������������䣬�����������Ӧ���ʼӿ� |
| C��ƽ��ʱ�������������䣬�����¶ȿ����SO2��ת���� |
| D�������������䣬ʹ�ò�ͬ�������÷�Ӧ��ƽ�ⳣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
2SO2+O2 2SO3�ǽӴ��������Ṥ���е���Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵���д������
2SO3�ǽӴ��������Ṥ���е���Ҫ��Ӧ�����й��ڸ÷�Ӧ��˵���д������
| A������SO2��Ũ���ܼӿ�÷�Ӧ������ |
| B��ͨ��ʹ���������� |
| C��������ϵ�¶Ȼ�����÷�Ӧ������ |
| D��ʹ�ô����ܸı�÷�Ӧ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ���¶��£��̶����Ϊ2L�ܱ������У�������Ӧ��2SO2(g)+O2(g) 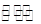 2SO3(g) ��H<0��n(SO2)��ʱ��ı仯�����
2SO3(g) ��H<0��n(SO2)��ʱ��ı仯�����
| ʱ�䣯min | 0 | 1 | 2 | 3 | 4 | 3 |
| n(SO2)��mol | 0.20 | 0.1 6 | 0.13 | 0.11 | 0.08 | 0.08 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��ס��������º��ݵ��ܱ������У��ֱ����һ������A��B��������Ӧ��A(g)��B(g) 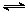 xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
xC(g) ��H��0�������������c(A)��ʱ��t�ı仯��ͼ��ʾ��
| ���� | �� | �� |
| �ݻ���L�� | 0.5 | 0.5 |
| ��Ӧ���ȣ�kJ�� | Q1 | Q2 |
| ��Ӧ����ʼ�� | 1 molA 1 molB | 0.5 molA 0.5 molB |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��һ�������ȵ��ܱշ�Ӧ���У�ֻ����������Ӧ��a(g)+b(g) 2c(g) ��H1<0��x(g)+3y(g)
2c(g) ��H1<0��x(g)+3y(g) 2z(g) ��H2<0��������ز����Ҵﵽƽ���(��������ı������Ĺ�)�����������������
2z(g) ��H2<0��������ز����Ҵﵽƽ���(��������ı������Ĺ�)�����������������
| A����ѹʱ��ͨ��������壬c�����ʵ������� |
| B����ѹʱ��ͨ��z���壬��Ӧ�����¶��½� |
| C������ʱ��ͨ��������壬����Ӧ���ʲ��� |
| D������ʱ��ͨ��z���壬z�����ʵ���Ũ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��֪��Ӧ4NH3��5O2 4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ����������ȷ�Ĺ�ϵ��(����)
4NO��6H2O������Ӧ���ʷֱ���v(NH3)��v(O2)��v(NO)��v(H2O)��ʾ����������ȷ�Ĺ�ϵ��(����)
A��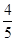 v(NH3)��v(O2) v(NH3)��v(O2) | B��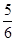 v(O2)��v(H2O) v(O2)��v(H2O) | C�� v(NH3)��v(H2O) v(NH3)��v(H2O) | D��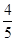 v(O2)��v(NO) v(O2)��v(NO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
��KI��Һ�д�������ƽ�⣺I2(aq)��I��(aq) I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ��K�����ʾ��
I3��(aq)����ò�ͬ�¶��¸÷�Ӧ��ƽ�ⳣ��K�����ʾ��
| t/�� | 5 | 15 | 25 | 35 | 50 |
| K | 1 100 | 841 | 689 | 533 | 409 |
 I3��(aq)�Ħ�H>0
I3��(aq)�Ħ�H>0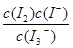
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com