
分析 根据n=$\frac{V}{{V}_{m}}$计算出标况下8.96L氢气的物质的量;设出铝和铁的物质的量,然后分别根据氢气的物质的量、金属总质量列式计算;Fe不与氢氧化钠溶液反应,只有Al反应,根据电子守恒计算出生成氢气的物质的量.
解答 解:标况下8.96L氢气的物质的量为:$\frac{8.96L}{22.4L/mol}$=0.4mol,
设混合物中含有铁和铝的物质的量分别为x、y,
根据总质量可得:56x+27y=11,
根据生成氢气的物质的量可得:x+1.5y=0.4,
联立解得:x=0.1mol、y=0.2mol,
所以混合物中铁的质量为:56g/mol×0.1mol=5.6g;
若将此混合物跟足量的氢氧化钠溶液反应,只有0.2molAl反应,根据电子守恒,生成氢气的物质的量为:$\frac{0.2mol×3}{0.2mol}$=0.3mol,
答:混合物中铁的质量为5.6g;若将此混合物跟足量的氢氧化钠溶液反应,能产生氢气0.3mol.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应原理为解答关键,注意掌握质量守恒定律在化学方程式中的应用方法,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
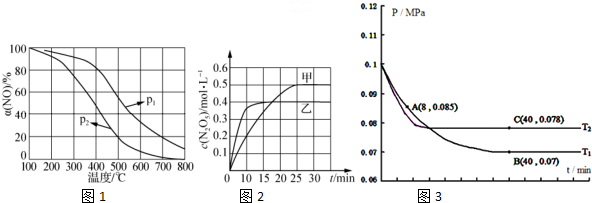
| 容器 | 甲 | 乙 | 丙 |
| 容积/L | 1 | 1 | 2 |
| 反应物起始量 | 1molO3、2molO2 | ||
| 1molO3、2molNO2 | |||
| 1molO3、2molN2O5 | |||
| 温度/K | T1 | T2 | T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
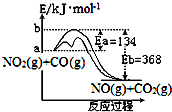 已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.
已知某反应的能量变化如图.在不同温度下,反应物初始浓度与初始反应速率有如表关系.| 实验序号 | 1 | 2 | 3 | 4 | |
| c(NO2)/mol•L-1 | 1 | 1 | 2 | 2 | |
| c(CO)/mol•L-1 | 1 | 2 | 1 | 2 | |
| v/mol•L-1•s-1 | 750K | p | 2p | 2p | 4p |
| 500K | q | q | 4q | 4q | |
| A. | 不同温度下,增加反应物的浓度不一定可以加快反应速率 | |
| B. | 加入催化剂,改变了反应的途径,加快了反应速率 | |
| C. | 升高反应温度,加快了反应速率,增大了平衡常数 | |
| D. | 750K时,将实验2的容器体积缩小一半,速率v为8p mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18O 存在于水中 | |
| B. | 反应中浓硫酸即是催化剂又是脱水剂 | |
| C. | 18O 存在于乙酸乙酯中 | |
| D. | 若与丙酸反应生成的酯的相对分子质量为104 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数 | |
| B. | 核电荷数和核外电子层排布的电子数 | |
| C. | 中子数和电子数 | |
| D. | 质量数和核外电子层排布的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
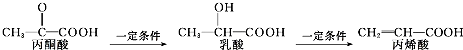
| A. | 三种有机物中都存在2种官能团 | |
| B. | 乳酸和丙烯酸都能使高锰酸钾酸性溶液褪色 | |
| C. | 1mol乳酸最多能与2molNa发生反应 | |
| D. | 三种有机物均能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”).
+(2n-1)H2O.有机物乙在水中的溶解情况是易溶于水(填“不溶于水”、“微溶于水”、“易溶于水”). +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$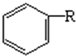
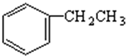 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$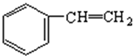 +H2
+H2 .
. .(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)
.(如不能发生反应,请填“否”;如能发生反应请写出其反应的方程式)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com