
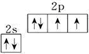
 ,氧的第一电离能在同周期元素中由大到小排第4位.
,氧的第一电离能在同周期元素中由大到小排第4位.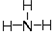 .
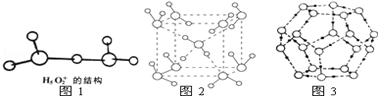
.
分析 (1)O原子价电子排布式为2s22p4,结合泡利原理、洪特规则画出价电子排布图;
同周期中稀有气体的电离能最大,其它元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
(2)根据杂化轨道数判断杂化类型,杂化轨道数=σ键数+孤对电子对数;计算O原子价层电子对数,确定水分子VSEPR模型;原子总数相等、价电子总数也相等的微粒互为等电子体;
(3)①铜离子含有空轨道,水分子含有孤对电子对,铜离子与水分子之间形成配位键,铜离子配体数为4,1个H2O含2个O-H键,则[Cu(H2O)4]2+含有12个σ键;
②氢离子含有空轨道,氧原子含有孤电子对,能形成配位键,O-H为极性键,单键属于σ键,O原子与H原子之间会形成氢键;
(4)暖冰为分子晶体,暖冰中水分子之间主要的作用力为氢键,电场作用下,水分子间更易制得“暖冰”;
(5)①以立方体中的水分子为研究对象,每个水分子形成4条氢键;每一条氢键连接2个水分子,故冰晶体中氢键数目为水分子数目的2倍;
②冰融化为液态水时,水分子数目不变,利用均摊法计算图2、图3中每个水分子形成氢键,减少的氢键即为破坏氢键;
③以立方体中的水分子为研究对象,每个水分子与周围4个水分子形成4个氢键,为正四面体构型,SiO2空间连接方式与这种冰连接类似;
④设体心立方中晶胞的棱长为X,O-H…O距离为A,则3X2=(2A)2,故X=$\frac{2A}{\sqrt{3}}$,利用均摊法计算晶胞中水分子数目,表示出晶胞质量,再根据ρ=$\frac{m}{V}$计算.
解答 解:(1)由于简并轨道(能级相同的轨道)中电子优先单独占据1个轨道,且自旋方向相同,原子的能量最低,O原子能量最低排布是 ;
;
同一周期内主族元素的第一电离能从左到右在总体增大的趋势中有些曲折.当外围电子在能量相等的轨道上形成全空、半满或全满结构时,原子的能量较低,元素的第一电离能较大,由于N元素的2p能级3个轨道处于半满,He元素的2P能级3个轨道处于全满,所以它们的第一电离能大小顺序是I1(He)>I1(F)>I1(N)>I1(O)>I1(C)>I1(Be)>I1(B),
故答案为: ;4;
;4;
(2)H2O中价层电子对个数=2+$\frac{1}{2}$(6-2×1)=4,且含有2个孤电子对,所以H2O的VSEPR模型为四面体,分子空间构型为V型,中心原子杂化方式为sp3,H3O+中O原子的质子数为8,H原子的质子数为1,所以H3O+的质子数为11,电子数=11-1=10,NH3的原子数目为4,电子数目为10,则与H3O+互为等电子体,结构式为: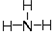 ,
,
故答案为:sp3;四面体形;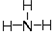 ;
;
(3)①Cu2+含有空轨道,H2O含有孤对电子,可形成配位键,铜离子配体数为4,配离子[Cu(H2O)4]2+中1个Cu2+与4个H2O形成配位键,1个H2O含2个O-H键,所以1mol水合铜离子中含有σ键数目为12NA,
故答案为:12NA;
②根据图1水合盐酸晶体H5O2+•Cl-中H5O2+离子的结构知:
a.氢离子含有空轨道,氧原子含有孤电子对,所以能形成配位键;
b.O-H形成极性键;
c.无非极性键;
d.因H5O2+中无阴阳离子,所以不存在离子键;
e.因H5O2+中无金属所以不存在金属键;
f.氢键存在于不直接相连的H与电负性较大的O原子间;
g.因H5O2+中无分子,所以不存在范德华力;
h.因H5O2+中无双键或三键,所以不存在π键;
i.O-H形成σ键,
故答案为:a b f i;
(4)水分子之间主要通过氢键形成固体,水分子是极性分子,在电场作用下定向有规则的排列,水分子间更易形成氢键,
故答案为:水分子是极性分子,在电场作用下定向有规则的排列,分子间通过氢键结合而成固体;
(5)①晶体冰中,每两个水分子间有一个氢键,平均属于每个水分子有半个,一个水分子与周围的四个水分子以氢键结合,故1mol冰中有2 mol氢键,
故答案为:2;
②冰融化为液态水时,水分子数目不变,图2中每个水分子平衡含有氢键数目为4×$\frac{1}{2}$=2,图3中每个水分子平衡含有氢键数目为3×$\frac{1}{2}$=1.5,则该冰熔化过程中氢键被破坏的百分比为 $\frac{2-1.5}{2}$×100%=25%,
故答案为:25%;
③二氧化硅是原子晶体,Si-O通过共价键形成四面体结构,四面体之间通过共价键形成空间网状结构,以立方体中的水分子为研究对象,每个水分子形成4条氢键,SiO2空间连接方式与这种冰连接类似,
故答案为:SiO2;
④体心立方晶胞中水分子个数=1+8×$\frac{1}{8}$=2;设体心立方中晶胞的棱长为X,O-H…O距离为A,则3X2=(2A)2,体心立方的密度ρ=$\frac{2m}{{N}_{A}×{X}^{3}}$=$\frac{18×2}{(\frac{2×295×1{0}^{-10}}{\sqrt{3}})×6.02×1{0}^{23}}$g/cm3=1.51g/cm3;
故答案为:$\frac{18×2}{(\frac{2×295×1{0}^{-10}}{\sqrt{3}})×6.02×1{0}^{23}}$=1.51.
点评 本题考查较为综合,涉及分子的立体构型、晶胞的计算,氢键、分子结构与杂化理论,注意晶体类型的有关计算,需要全面掌握基础知识,并能运用分析解决问题,难点是晶胞计算,题目难点中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定有甲烷 | B. | 一定有乙烯 | C. | 一定没有甲烷 | D. | 可能有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Fe(NO3)2和KI混合溶液中加入少量稀盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑ | |
| B. | 非金属元素形成的化合物一定是共价化合物 | |
| C. | SO2通入Ca(ClO)2溶液中:SO2+Ca2++ClO-+H2O=CaSO4↓+2H++Cl- | |
| D. | 只含有共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )
在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如图,下列表述中正确的是( )| A. | 反应的化学方程式为:N?2M | |
| B. | t2时,正逆反应速率相等,达到平衡 | |
| C. | t3时,正反应速率等于逆反应速率 | |
| D. | t3后,若升高温度则反应速率不一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
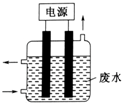
| A. | 该电解装置电极材料均为铁 | |
| B. | 除去CN-的反应:2CN-+5ClO-+2OH-=N2↑+2CO32-+5Cl-+H2O | |
| C. | 阴极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O | |
| D. | 该装置排放出的气体主要为N2和CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com