
1mol X气体跟a mol Y气体在体积可变的密闭容器中发生如下反应:X(g) + aY(g) bZ(g),反应达到平衡后,测得X的转化
bZ(g),反应达到平衡后,测得X的转化 率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
率为50% 。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,则a和b的数值可能是
A.a=l,b=2 B.a=2,b=1 C.a=2,b=2 D.a=3,b=2
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2016-2017学年江苏省徐州市高二上第一次月考化学试卷(解析版) 题型:推断题
A~J是中学化学中常见的化学物质,它们之间的相互转化关系如下列框图所示(部分反应的产物未列出)。
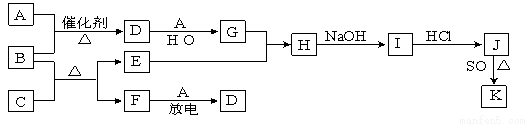
已知:A、F为无色气体单质,B为无色具有刺激性气味的碱性气体,C为黑色氧化物,E为红色金属单质。请回答下列问题:
(1)D的化学式为 ;F的电子式为 。
(2)B和C反应的化学方程式为 。该反应中生成1molF时,转移的电子数为 mol
(3)E与G的稀溶液反应的离子方程式为: 。
(4)J、K是同种金属的不同氯化物,K为白色沉淀。写出SO2还原J生成K的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:填空题
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数减小,则:
(1)该反应的逆反应为________反应(填“吸热”或“放热”),且m+n________p(填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A的质量分数__________。(填“增大”、“减小”或“不变”,下同)
(3)若加入B(维持体积不变),则A的转化率____________。
(4)若升高温度,则平衡时B、C的浓度之比将____________。
(5)若加入催化剂,平衡时气体混合物的总物质的量__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省新乡市高二上第一次月考化学卷(解析版) 题型:选择题
通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):
化学键 | H—H | Br—Br | H—Br |
键能/(kJ·mol-1) | 436 | 193 | 366 |
请计算H2(g)+Br2(g)==2HBr(g)的反应热( )
A.+103 kJ·mol-1 B.+679 kJ·mol-1 C.-103 kJ·mol-1 D.+183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:填空题
(1)化学平衡常数K表示可逆反应进行程度,K值越大,表示  ,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
,K值大小与温度的关系是:△H<0(正反应放热),当温度升高K值 。
(2)在一体积为10L的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g) + H2O(g) CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如下图所示,则0~4min的平均速率v(CO)= 。

(3)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表。
t1℃时物质浓度(mol/L)的变化
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | c1 | c2 | c3 | c3 |
4 | c1 | c2 | c3 | c3 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
①表中3~4min反应处于 状态;c1数值 0.08mol/L(填“>”“<”“=”)
②反应在4~5min,平衡向逆方向移动,可能的原因是 (单选),表中5~6min数值发生变化,可能的原因是 (单选)
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上半期考试化学卷(解析版) 题型:选择题
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,在等体积、等浓度的硝酸中加入 氨水,溶液的导电性增强
氨水,溶液的导电性增强
C.25℃时,0.1mol/L的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当
D.25℃时,将等体积pH=1的盐酸和水混合,混合后溶液的pH=1.3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:填空题
(1) 常温下,某水溶液M中存在的离子有:Na+、A2-、HA-、H+、OH-,存在的分子有H2O、H2A,根据题意回答下列问题:
①写出酸H2A的电离方程式__________________。
②若溶液M由10mL 2 mol·L-1NaHA溶液与2mol·L-1NaOH溶液等体积混合而得,则溶液M的pH ________7 (填“>”、“<”或“=”),溶液M中各微粒的浓度关系正确的是__________。
A.c(Na+)>c(A2-)>c(OH-)>c(H+)
B.c(HA-)+c(H2A)+c(H+)=c(OH-)
C.c(A2-)+c(HA-)+c(H2A)=1mol·L-1
D.c(A2-)+c(HA-)+c(OH-)=c(Na+)+c(H+)
(2) CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3
①Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,试写出CO32-水解的离子方程式(忽略第二步水解)______________,其水解反应的平衡常数(即水解常数)的表达式为Kh=__________。
②已知25℃时,Kh=2×10-4mol/L,则当溶液中c(HCO3-):c(CO32-)=2:1时,试求溶液的pH=__________。
③0.1mol/L Na2CO3溶液中c(OH-)-c(H+)=__________(用含c(HCO3-)、c(H2CO3)的关系式表示)
④向 Na2CO3溶液中加入明矾会产生沉淀和气体,请写出相关的离子方程式__________________。
(3)实验室可用NaOH溶液吸收NO2,反应为2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH 的水溶液与 0.2molNO2恰好完全反应得1L溶液A,溶液B为0.1mol·L-1的CH3COONa溶液,则两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为__________。(已知HNO2的电离常数Ka=7.1×10-4mol·L-1,CH3COOH的电离常数Ka=1.7×10-5mol·L-1),可使溶液A和溶液B的pH相等的方法是____________。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)
n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①由上表判断NaHSO3溶液显____性,用化学平衡原理解释:______________________。
②当吸收液呈中性时,溶液中出离子浓度关系正确的是(选填字母)_________________。
A.c(Na+)=2c(SO32-)+c(HSO3-)
B.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
C.c(Na+)+c(H+)=c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定条件下一定能大量共存的是
A.弱碱性溶液中:Na+、K+、Cl-、HCO3-
B.无色溶液中:Al3+、NH4+、Cl-、HCO3-
C.pH=1的溶液中:ClO-、SO42-、Fe2+、K+
D.由水电离的c(OH-)=10-14mol· L-1的溶液中:CH3COO-、SO42-、Na+、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 解释、结论 |
| A | 长期露置于潮湿空气中的Fe粉中加入足量的稀盐酸充分反应,滴入KSCN溶液 | 溶液呈红色 | 稀盐酸将Fe氧化为Fe3+ |
| B | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | 析出了Na2CO3晶体 |
| C | Al箔插入浓硝酸中 | 无现象 | Al在浓硝酸中钝化,形成致密的氧化膜 |
| D | 用玻璃棒蘸取浓氨水点到蓝色石蕊试纸上 | 试纸变红色 | 浓氨水呈碱性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com