
| A. | SO2可用于漂白纸浆 | B. | SiO2是良好的半导体材料 | ||
| C. | Na2O2可用作潜水艇O2来源 | D. | Cl2可用于消毒和制造漂白粉 |
科目:高中化学 来源: 题型:选择题
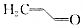 .则与键线式为
.则与键线式为 的物质互为同分异构体的是( )
的物质互为同分异构体的是( )| A. | 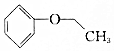 | B. |  | C. | 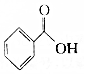 | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CH3OH(l)的燃烧热为238.6 kJ•mol-1,则CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g)△H=-238.6 kJ•mol-1 | |
| B. | 钢铁水闸可用牺牲阳极或外加电流的阴极保护法防止其腐蚀 | |
| C. | 反应H2+Cl2═2HCl(△H<0)的机理包含①Cl2-→2Cl(慢),②H2+Cl-→HCl+H(快),③Cl2+H-→HCl+Cl(快),则反应①的活化能小于反应②的活化能 | |
| D. | 一定条件下反应N2+3H2?2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知,常温下H2S、H2CO3的电离常数如表
已知,常温下H2S、H2CO3的电离常数如表| Ka1 | Ka2 | |
| H2S | 9.1×10-8 | 1×10-15 |
| H2CO3 | 4.3×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1 | B. | 1:1 | C. | 1:2 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
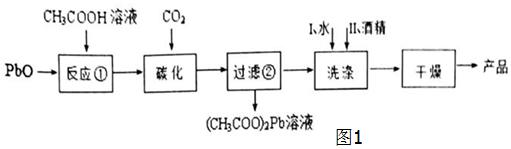
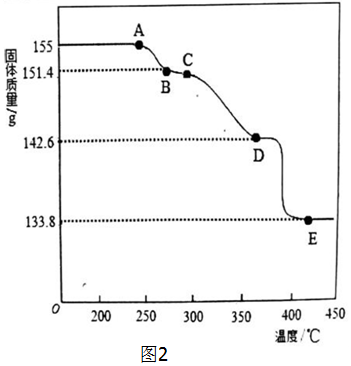
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分类是学习和研究化学物质及其变化的一种常用方法 | |
| B. | 有些液态胶体也是透明的,用肉眼很难与溶液相区别 | |
| C. | 2 L1 mol/L Na2 CO3溶液中c(Na+)为4 mol/L | |
| D. | 从1 LNaCl溶液中取出100 ml,其浓度与原1L溶液相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com