
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O |
方法c | 电解法,反应为2Cu + H2O |
方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(1)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-169kJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-110.5kJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-157kJ·mol-1
则方法a发生的热化学方程式是:________________________。
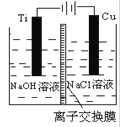
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如下图所示:
该离子交换膜为______离子交换膜(填“阴”或“阳”),该电池的阳极反应式为:_____________ 钛极附近的pH值________ (增大、减小、不变)。
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为:____________。
(4)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
2H2O![]() 2H2+O2 ΔH>0
2H2+O2 ΔH>0
水蒸气的浓度随时间t变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.0500 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.1000 | 0.0940 | 0.0900 | 0.0900 | 0.0900 | 0.0900 |
①对比实验的温度T2_____ T1(填“>”“<”或“=”)。
②实验①前20 min的平均反应速率v(O2)=______。
③催化剂催化效率:实验①______实验② (填“>”、“<")。
【答案】 C(s)+2CuO(s)=Cu2O(s)+CO(g) ΔH=+ 34.5kJ/mol 阴 2Cu-2e-+2OH-=Cu2O+H2O 增大 4Cu(OH)2+ N2H4![]() 2Cu2O+N2↑+6H2O > 3.5×10-5mol/(L·min) <
2Cu2O+N2↑+6H2O > 3.5×10-5mol/(L·min) <
【解析】⑴.已知:① 2Cu(s)+1/2O2(g)=Cu2O(s)△H =-169kJ·mol-1
② C(s)+1/2O2(g)=CO(g)△H =-110.5kJ·mol-1
③ Cu(s)+1/2O2(g)=CuO(s)△H =-157kJ·mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为:C(s)+2CuO(s)=Cu2O(s)+CO(g)该反应可以是②-③×2-①÷2,反应的焓变是:-110.5kJmol-1-(-157kJmol-1×2)-(-169kJmol-1)÷2 = +34.5kJmol-1,
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1;
⑵.方法c采用离子交换膜控制电解液中OH-的浓度,则只有使用阴离子交换膜才能控制氢氧根离子浓度;在电解池中,当阳极是活泼电极时,该电极本身发生失电子的氧化反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O;钛极是阴极,发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:阴;2Cu-2e-+2OH-=Cu2O+H2O;增大;
⑶.根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O,
2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4![]() 2Cu2O+N2↑+6H2O;
2Cu2O+N2↑+6H2O;
⑷.①. 该反应的正反应是吸热反应,升高温度平衡正向移动,水蒸气转化率增大,②和③相比,③转化率高,所以T2>T1,故答案为:>;
②前20min内用水蒸气表示的反应速率=(0.050-0.0486)mol/L÷20min =7×10-5mol/(Lmin),同一反应中同一段时间内各物质的反应速率之比等于其化学计量数之比,则用氧气表示的反应速率=3.5×10-5mol/(Lmin),故答案为:3.5×10-5mol/(Lmin);
③.实验①②对比,实验②到达平衡时间短,反应速率快,所以②中催化剂的催化效率高,故答案为:<。


科目:高中化学 来源: 题型:
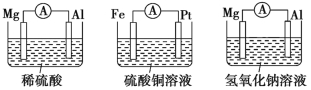
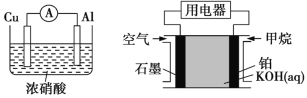
【题目】为了探究原电池的工作原理,某化学学习小组设计了一组实验,其装置如图所示:
甲 乙 丙
丁 戊
回答下列问题:
(1)根据原电池原理填写下表:
装置序号 | 正极 | 负极反应式 | 阳离子移动方向 |
甲 | |||
乙 | |||
丙 | |||
丁 | |||
戊 |
(2)电极类型除与电极材料的性质有关外,还与 有关。
(3)根据上述电池分析,负极材料是否一定参加电极反应? (填“是”、“否”或“不一定”),用上述电池说明: 。
(4)上述电池放电过程中,电解质溶液酸碱性的变化:甲 ,丙 ,戊 。(均填“酸性减弱”或“碱性减弱”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 同周期的IIA族与ⅢA族元素的原子序数一定相差1
B. 第三周期非金属元素含氧酸的酸性从左到右依次增强
C. 元素的非金属性越强,其气态氢化物水溶液的酸性越强
D. 镁、铝、铜、铁、钠五种金属元素中,铜和铁属于过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述正确的是
①用稀盐酸洗涤盛放过石灰水的试剂瓶;
②配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌;
③有六种分别含Na+、Mg2+、Al3+、Fe2+、Fe3+、NH4+阳离子的溶液,不能用NaOH溶液鉴别;
④用稀硝酸清洗做过银镜反应实验的试管;
⑤如果皮肤上不慎沾有苯酚,应立即用大量的NaOH稀溶液冲洗;
⑥用瓷坩埚高温熔融Fe(CrO2)2和Na2CO3的固体混合物;
⑦向沸腾的NaOH稀溶液中滴加FeCl3饱和溶液,以制备Fe(OH)3胶体;
⑧向某溶液加入NaOH浓溶液并加热能产生能使湿润的红色石蕊试纸变蓝的气体则原溶液中含NH4+
A. ①⑤⑦ B. ③④⑦⑧ C. ①②④⑧ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用胆矾配制0.2mol/L的CuSO4溶液,下列操作正确的是( )
A.取50g胆矾溶于1L水中
B.取50g胆矾溶于水配成1L溶液
C.取32g胆矾溶于水配成1L溶液
D.取无水硫酸铜32g溶于1L水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”实验已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图甲所示装置
②实验室中做氯气与钠的反应实验时采用图乙所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图丙所示装置进行铜与稀硝酸的反应
A. ②③④
B. ①②③
C. ①②④
D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化在给定条件下能实现的是 ( )
①Al2O3![]() NaAlO2(aq)
NaAlO2(aq)![]() Al(OH)3
Al(OH)3
②S![]() SO3
SO3![]() H2SO4
H2SO4
③饱和NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
④Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
⑤MgCl2(aq)![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO
A. ①③⑤ B. ②③④ C. ②④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 三氯化碘(ICl3)在药物合成中用途非常广泛,其熔点:33℃,沸点:73℃。实验室可用下图所示装置制取ICl3 :
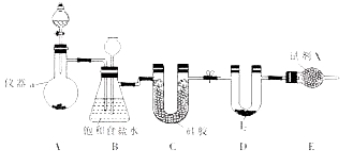
(1)仪器a 的名称是 。
(2)制备氯气选用的药品为漂白粉固体[主要成分为Ca(ClO)2]和浓盐酸,有关反应的化学方程式为 。
(3)装置B(吸滤瓶)即可用于除杂,也是安全瓶,能监侧实验进行时装置C中是否发生了堵塞。请描述发生堵塞时B中现象 。
(4)试剂X为 。
(5)氯气与单质碘需在温度稍低于70℃下反应,则装置D适宜的加热方式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com